
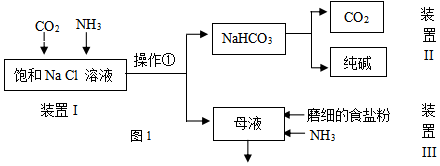
| NaCl | NH4HCO3 | NaHCO3 | NH4Cl | |
| 溶解度(20°C,100gH2O时) | 36.0 | 21.7 | 9.6 | 37.2 |
分析 (1)工业上除去Mg2+用含有OH-的可溶性碱、除去Ca2+用含有CO32-的可溶性盐,且这两种试剂必须价格低廉;
(2)①NaCl、CO2、NH3、H2O发生反应生成NaHCO3和NH4Cl;
②酸和碱反应生成盐和水而相互促进溶解,且NaCl的溶解度大于碳酸氢钠,溶解度大的物质向溶解度小的物质转化;
③分离沉淀和溶液采用过滤方法;
(3)受热条件下,碳酸氢钠分解生成碳酸钠、二氧化碳和水;
(4)在母液中含有大量的NH4+和Cl-,氯化铵存在溶解平衡,增大离子浓度抑制其溶解;
(5)从母液中能分离出氯化钠,装置II中得到二氧化碳,装置I中需要二氧化碳和氯化钠;
(6)a.只有氯化钙能和碳酸钠反应生成碳酸钙,根据碳酸钙的量计算碳酸钠的量;
b.只有碳酸钠能和稀硫酸反应生成二氧化碳,根据二氧化碳的量计算碳酸钠的量;
c.碳酸根离子和氯离子都能和银离子反应生成白色沉淀.
解答 解:(1)工业上除去Mg2+用含有OH-的可溶性碱、除去Ca2+用含有CO32-的可溶性盐,且这两种试剂必须价格低廉,除去镁离子用氢氧化钙、除去钙离子用碳酸钠,
故答案为:Ca(OH)2;Na2CO3;
(2)①NaCl、CO2、NH3、H2O发生反应生成NaHCO3和NH4Cl,反应方程式为NaCl+CO2+NH3+H2O=NaHCO3+NH4Cl,
故答案为:NaCl+CO2+NH3+H2O=NaHCO3+NH4Cl;
②在溶液中存在下述两种平衡NH3+H2O?NH3•H2O?NH4++OH-,CO2+H2O?H2CO3?H++HCO3-,OH-与H+结合生成水,促进两平衡正向移动,使溶液中的NH4+和HCO3-浓度均增大,由于NaHCO3溶解度小,因此HCO3-与Na+结合生成NaHCO3,固体析出使得反应发生,
故答案为:在溶液中存在下述两种平衡NH3+H2O?NH3•H2O?NH4++OH-,CO2+H2O?H2CO3?H++HCO3-,OH-与H+结合生成水,促进两平衡正向移动,使溶液中的NH4+和HCO3-浓度均增大,由于NaHCO3溶解度小,因此HCO3-与Na+结合生成NaHCO3,固体析出使得反应发生;
③分离沉淀和溶液采用过滤方法,所以该操作名称是过滤,故答案为:过滤;
(3)受热条件下,碳酸氢钠分解生成碳酸钠、二氧化碳和水,反应方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(4)在母液中含有大量的NH4+和Cl-,氯化铵存在溶解平衡,增大离子浓度抑制其溶解,所以在母液中含有大量的NH4+和Cl-,存在平衡NH4Cl(s)?NH4++Cl-,通入氨气增大NH4+的浓度,加入磨细的食盐粉,增大Cl-的浓度,使上述平衡逆向移动,促使氯化铵结晶析出,
故答案为:在母液中含有大量的NH4+和Cl-,存在平衡NH4Cl(s)?NH4++Cl-,通入氨气增大NH4+的浓度,加入磨细的食盐粉,增大Cl-的浓度,使上述平衡逆向移动,促使氯化铵结晶析出;
(5)装置III中从母液中能分离出氯化钠,装置II中得到二氧化碳,装置I中需要二氧化碳和氯化钠,所以能循环利用的是氯化钠和二氧化碳,
故答案为:氯化钠和二氧化碳;
(6)a.只有氯化钙能和碳酸钠反应生成碳酸钙,根据碳酸钙的量计算碳酸钠的量,所以该方案可以,故a不选;
b.只有碳酸钠能和稀硫酸反应生成二氧化碳,根据二氧化碳的量计算碳酸钠的量,所以该方案可以,故b不选;
c.碳酸根离子和氯离子都能和银离子反应生成白色沉淀,无法计算碳酸钠的量,所以该方案不可以,故c选;
故选c.
点评 本题考查物质制备,为高频考点,涉及物质制备、物质分离提纯、实验方案设计评价等知识点,明确物质性质及物质制备原理是解本题关键,注意除杂剂的选取方法,题目难度不大.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 12.0gNaHSO4晶体中阳离子数为0.2NA个 | |
| B. | 0.1 mol Cu与足量热的浓硫酸反应生成SO2的体积约为22.4 L | |
| C. | T℃时,1L pH=6的纯水中,含1×10-6NA个H+ | |
| D. | 标准状况下,1 L pH=13的NaOH溶液中OH-为0.1NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 支持海港码头基础的防腐技术,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极.下列有关表述不正确的是( )
支持海港码头基础的防腐技术,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极.下列有关表述不正确的是( )| A. | 通入保护电流使钢管桩表面腐蚀电流接近于零 | |
| B. | 通电后外电路电子被强制从高硅铸铁流向钢管桩 | |
| C. | 高硅铸铁的作用是作为损耗阳极材料和传递电流 | |
| D. | 通入的保护电流应该根据环境条件变化进行调整 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验设计 | |
| A. | 除去NaHCO3固体中的Na2CO3 | 将固体加热至恒重 |
| B. | 制备无水AlCl3 | 蒸发Al与稀盐酸反应后的溶液 |
| C. | 重结晶提纯苯甲酸 | 将粗品水溶、过滤、蒸发、结晶 |
| D. | 鉴别NaBr和KI溶液 | 分别加新制氯水后,用CCl4萃取 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
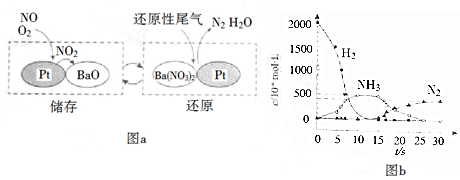
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升温 | B. | 增大反应器的体积 | ||
| C. | 增大c(A) | D. | 降温 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.25g | B. | 1.32g | C. | 1.97g | D. | 2.44g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com