
����Ŀ����������M��һ��ҩ�����Ҫ�ϳ��м��壬��ϳ�·�����£�

��֪������Ϣ��
�ٷ�����A����Է���������100��110֮�䣬1molA��ȫȼ�տ�����10molO2��
��H�ĺ˴Ź���������ʾ����3���⡣
��RCH=CH2![]() RCHClCH3
RCHClCH3
��RX+Mg![]() RMgX(X����±��)
RMgX(X����±��)
��
![]()


�ش��������⣺
(1)A�Ľṹ��ʽΪ______��H�й����ŵ�����Ϊ______��
(2)��E��H����M�Ļ�ѧ����ʽΪ______��
(3)����������Ӧ����______(�����)��
(4)ͬʱ��������������E��ͬ���칹����______��(�����������칹)�����б�����һ�ȴ���ֻ�����ֵĽṹ��ʽΪ______��(��дһ��)
������̼������Һ������Ӧ���ڱ����ϵ�ȡ������Ŀ��2��
(5)����������Ϣ���ɱ��ϳɱ���ϩ���ϳ�·����ͼ��ʾ����ش��������⡣

�Լ���Ϊ______�����һ����Ӧ�Ļ�ѧ����ʽΪ______��
���𰸡�![]() �Ȼ�������
�Ȼ������� 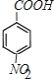 +
+
![]()
 +H2O
+H2O ![]() 6
6 ![]() ��
��![]() �� CH3CHO
�� CH3CHO ![]()
![]()
![]() +H2O
+H2O
��������
������A����Է���������100��110֮�䣬1molA��ȫȼ�տ�����10molO2����A�ķ���ʽΪCxHy����x+![]() =10����ϸ������ķ���ʽͨʽ��ͨ�����ۣ��ɵõ������ʷ���ʽΪC8H8��A�ܹ���HCl�����ӳɷ�Ӧ����B����A�Ľṹ��ʽΪ
=10����ϸ������ķ���ʽͨʽ��ͨ�����ۣ��ɵõ������ʷ���ʽΪC8H8��A�ܹ���HCl�����ӳɷ�Ӧ����B����A�Ľṹ��ʽΪ![]() ��������Ϣ�ۿ�֪B�Ľṹ��ʽΪ
��������Ϣ�ۿ�֪B�Ľṹ��ʽΪ![]() ��B���������Ƶ�ˮ��Һ�м�������C����CΪ
��B���������Ƶ�ˮ��Һ�м�������C����CΪ![]() ��C����������D����DΪ
��C����������D����DΪ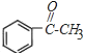 �������Ϣ�ݿ�֪EΪ
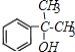
�������Ϣ�ݿ�֪EΪ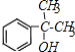 ��F����������Ӧ����G��G�����Ը��������Һ��������H��H�ĺ˴Ź������ױ�����3�ֲ�ͬ��ѧ�������⣬��HΪ
��F����������Ӧ����G��G�����Ը��������Һ��������H��H�ĺ˴Ź������ױ�����3�ֲ�ͬ��ѧ�������⣬��HΪ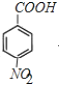 ��GΪ
��GΪ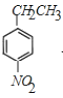 ��H��E����������Ӧ����M����MΪ
��H��E����������Ӧ����M����MΪ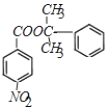 ���Դ˽����⡣
���Դ˽����⡣
(1)���ݷ�����֪��A�Ľṹ��ʽΪ��![]() ��HΪ
��HΪ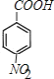
(2)EΪ ��HΪ
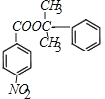
��HΪ �����߷���������Ӧ�γ���M�Ļ�ѧ����ʽΪ��
�����߷���������Ӧ�γ���M�Ļ�ѧ����ʽΪ�� +
+
![]()
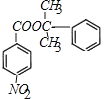 +H2O��
+H2O��
(3)�������̿�֪����Ӧ��Ϊ�ӳɷ�Ӧ����Ӧ��Ϊȡ����Ӧ����Ӧ��Ϊ������Ӧ����Ӧ��Ϊ�ӳɷ�Ӧ����Ӧ��Ϊȡ����Ӧ����Ӧ��Ϊ������Ӧ����Ӧ��Ϊ������Ӧ��Ҳ����ȡ����Ӧ����Ӧ��������������Ӧ��Ϊ�ۢޣ�
(4)E�Ľṹ��ʽΪ ��E��ͬ���칹���������������������̼������Һ������Ӧ��˵�����л�������к��з��ǻ����ڱ�����������ȡ�������������������л�������б��������ӵ�������������Ϊ��-OH��-CH2CH2CH3��-OH��-CH(CH3)2������2�������ÿ�ֺ����ڡ��䡢������ͬ���칹�壬�������������Ľṹ��ʽ����Ϊ��2��3=6�֣����б�����һ�ȴ���ֻ�����֣�˵������жԳƽṹ�����������Ľṹ��ʽΪ��
��E��ͬ���칹���������������������̼������Һ������Ӧ��˵�����л�������к��з��ǻ����ڱ�����������ȡ�������������������л�������б��������ӵ�������������Ϊ��-OH��-CH2CH2CH3��-OH��-CH(CH3)2������2�������ÿ�ֺ����ڡ��䡢������ͬ���칹�壬�������������Ľṹ��ʽ����Ϊ��2��3=6�֣����б�����һ�ȴ���ֻ�����֣�˵������жԳƽṹ�����������Ľṹ��ʽΪ��![]() ��
��![]() ��
��
(5)�������Ϣ��֪�Լ���ΪCH3CHO�����һ��������ȥ��Ӧ����Ӧ�Ļ�ѧ����ʽΪ![]()
![]()
![]() +H2O��
+H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�ij��HA�ĵ��볣����K=1��10-5������˵����ȷ����
A. HA��Һ�м���NaA�����![]() ��С
��С
B. �����£�0.1mol/LHA��Һ��ˮ�����c(H+)Ϊ10-13mol/L
C. NaA��Һ�м���HCl��Һ��ǡ����ȫ��Ӧ�����ڹ�ϵ��2c(Na+)=c(A-)+ c(Cl-)
D. �����£�0.1mol/LNaA��Һˮ�ⳣ��Ϊ10-9
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.��Դ�ǹ��÷�չ����Ҫ�������ҹ�Ŀǰʹ�õ���Դ��Ҫ�ǻ�ʯȼ�ϡ�
��֪��C��s����O2��g��===CO2��g������H1����393.5 kJ��mol��1
H2��g����![]() O2��g��===H2O��g������H2����241.8 kJ��mol��1
O2��g��===H2O��g������H2����241.8 kJ��mol��1
CO��g����![]() O2��g��===CO2��g������H3����283.0 kJ��mol��1
O2��g��===CO2��g������H3����283.0 kJ��mol��1
��ú������Ҫ��ӦC��s����H2O��g��=CO��g����H2��g������H��____________________��
��.Ϊ�˼���CO���ŷţ�ij�����о�С����CO��H2Ϊԭ�Ϻϳ������Դ�����ѣ�DME������Ӧ���£�4H2��g����2CO��g��![]() CH3OCH3��g����H2O��g������H����198 kJ��mol��1��
CH3OCH3��g����H2O��g������H����198 kJ��mol��1��
��1����ͼ��ʾ����ȷ��ӳƽ�ⳣ��K���¶ȱ仯��ϵ������Ϊ________�������߱����ĸ�������ж�������____________��

��2����һ���¶��£���2.0 L�̶��ݻ����ܱ������г���2 mol H2��1 mol CO������һ��ʱ���Ӧ4H2��g����2CO��g��![]() CH3OCH3��g����H2O��g���ﵽƽ�⡣��Ӧ�����в�õIJ������ݼ��±���
CH3OCH3��g����H2O��g���ﵽƽ�⡣��Ӧ�����в�õIJ������ݼ��±���
ʱ��/min | 0 | 20 | 40 | 80 | 100 |
n��H2��/mol | 2.0 | 1.4 | 0.85 | 0.4 | �� |
n��CO��/mol | 1.0 | �� | 0.425 | 0.2 | 0.2 |
n��CH3OCH3��/mol | 0 | 0.15 | �� | �� | 0.4 |
n��H2O��/mol | 0 | 0.15 | 0.2875 | 0.4 | 0.4 |
��0��20 min��ƽ����Ӧ����v��CO����__________________mol��L��1��min��1��
�ڴﵽƽ��ʱ��H2��ת����Ϊ__________________��
���������¶��£��÷�Ӧ��ƽ�ⳣ��K��______________________��
���ܱ����÷�Ӧ�ﵽƽ��״̬����________������ţ���
A CO��ת���ʵ���H2O�IJ��� B ��������ƽ����Է�����������
C v��CO����v��H2���ı�ֵ���� D ���������ܶȲ���
���������¶��£���ƽ����2 L�������ٳ���0.4 mol H2��0.4 mol CH3OCH3��g������ѧƽ��________�ƶ���������������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ����ȷ������ ��
A. �� Ca(OH)2�� NaOH�Ļ����Һ��ͨ ��CO2
B. �� FeCl3 ��Һ�м���п��
C. �� NaOH ��Һ��ͨ��CO2
D. HCl��Cl2�Ļ������ͨ��NaOH��Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. �����ܱ������н��еķ�Ӧ��A��s����3B��g��![]() 2C��g����D��g������������ܶȱ��ֲ��䣬˵����Ӧ�Ѿ��ﵽƽ��
2C��g����D��g������������ܶȱ��ֲ��䣬˵����Ӧ�Ѿ��ﵽƽ��
B. C ( s) + H2O (g) ![]() CO ( g) + H2 (g)�������������䣬��С��������������ʼ�С������������
CO ( g) + H2 (g)�������������䣬��С��������������ʼ�С������������
C. N2(g) + 3H2(g)![]() 2NH3(g) ��H=��93kJ��mol��1���������ܱ������г���0.4 molN2(g)��2 mol H2(g)�ﵽƽ��ʱ�����Էų�37.2 kJ������
2NH3(g) ��H=��93kJ��mol��1���������ܱ������г���0.4 molN2(g)��2 mol H2(g)�ﵽƽ��ʱ�����Էų�37.2 kJ������
D. A(g)+ 3B (g) ![]() 2C (g) + D (g)�������ֲ�ͬ����µķ�Ӧ���ʷֱ�Ϊ����
2C (g) + D (g)�������ֲ�ͬ����µķ�Ӧ���ʷֱ�Ϊ����![]() ����
����![]() ����ǰ�߱Ⱥ��߿�
����ǰ�߱Ⱥ��߿�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ���¶��£�������Һ������Ũ�ȹ�ϵʽ��ȷ����
���¶��£�������Һ������Ũ�ȹ�ϵʽ��ȷ����![]()
A.![]() ��
��![]() ��Һ�У�
��Һ�У�![]()
B.ϡ�Ͱ�ˮ��Һ10������![]() Ϊԭ����
Ϊԭ����![]()
C.pH֮��Ϊ14��![]() ��NaOH��Һ��ϣ�
��NaOH��Һ��ϣ�![]()
D.�������ʵ�����![]() ��
��![]() �������ˮ�У�
�������ˮ�У�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������![]() �㷺Ӧ���ںϽ���Դ���������������������������ͼ�����־������������ֵķ���֮һ��
�㷺Ӧ���ںϽ���Դ���������������������������ͼ�����־������������ֵķ���֮һ��![]() �־�����Ҫ�ɷ����ֵ������������������
�־�����Ҫ�ɷ����ֵ������������������![]()
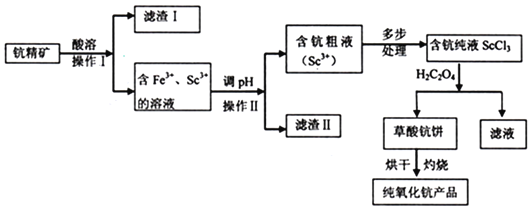
�ش��������⣺
![]() ����I��______
����I��______![]() �ѧʽ
�ѧʽ![]() ����ʵ������������Ҫ�IJ����������ձ���______��
����ʵ������������Ҫ�IJ����������ձ���______��
![]() ��pH��Ŀ����______����μ��麬�ִ�Һ�в���
��pH��Ŀ����______����μ��麬�ִ�Һ�в���![]() ����______��
����______��
![]() д����ȡ�����ֱ��Ļ�ѧ����ʽ______��
д����ȡ�����ֱ��Ļ�ѧ����ʽ______��
![]() д�������ֱ��ڿ��������յĻ�ѧ����ʽ______��ÿ����
д�������ֱ��ڿ��������յĻ�ѧ����ʽ______��ÿ����![]() ��ת�Ƶĵ�����Ϊ______��
��ת�Ƶĵ�����Ϊ______��
![]() ij������
ij������![]() ���־����Ʊ��������֣��õ�����Ʒ
���־����Ʊ��������֣��õ�����Ʒ![]() �����־������ֵ�����������______
�����־������ֵ�����������______![]() ����Sc��������Ϊ
����Sc��������Ϊ![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ȡ����������ʵ��װ����ͼ��ʾ������˵����ȷ���ǣ� ��

A.�Թ�A�У����μ������Ũ���ᡢ�Ҵ�������
B.B�м�����DZ���Na2CO3��Һ
C.B�еĵ���Ҳ�������뵽Һ������
D.ʵ�������B���²���������Ͳ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������[(C6H11O7)2Fe]��ҽ���ϳ��õIJ�������������ˮ�������������Ҵ���ijʵ��С��ͬѧ������ͼװ�����Ʊ�FeCO3������FeCO3���������ᷴӦ��һ���Ƶ���������������
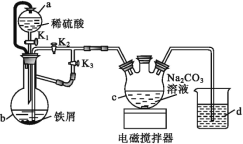
��ش��������⣺
��1������ͨ©���Ƚϣ�a©�����ŵ���___��
��2������ͼ���Ӻ�װ�ã���������Ժ����ҩƷ����K1��K3���ر�K2��
��b�е�ʵ������___��
��һ��ʱ��ر�___����___(ѡ����K1����K2������K3��)���۲쵽b�е���Һ������c�У�ͬʱc������FeCO3������
��b����������������___��
��3����c���Ƶõ�̼�������ڿ����й���ʱ��ϳ�ʱ��������Ϊ���ɫ���û�ѧ����ʽ˵����ԭ��___��
��4��������������̼��������ϣ��뽫��Һ��pH������5.8����ԭ����___����������Һ�м����Ҵ�����������Ʒ�������Ҵ���Ŀ����___��
��5����ͬѧ�����NaHCO3��Һ����Na2CO3��Һ�Ƶõ�̼���������ȸ��ߣ�����ܵ�ԭ����___��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com