
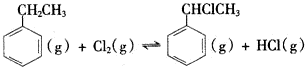
分析 (1)根据题干信息:亚磷酸是二元酸存在电离平衡为弱酸,亚磷酸与足量NaOH溶液反应,生成Na2HPO3,据此书写离子方程式;
(2)银离子还原为银单质,反应中银离子是氧化剂,氧化产物的化学式为H3PO4,则H3PO3是还原剂,根据转移电子守恒计算氧化剂与还原剂的物质的量之比;
(3)电离平衡常数K=$\frac{c({H}^{+})•c({H}_{2}P{O}_{3}^{-})}{c({H}_{3}P{O}_{3})}$;
(4)向H3PO3溶液中滴加NaOH溶液至中性,根据电荷守恒和质子守恒可得;
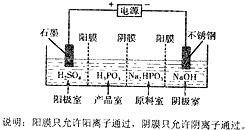
(5)①产品室中HPO32-和氢离子结合 生成亚磷酸;
②阴极上得电子发生还原反应,电极反应式为2H++2e-=H2↑;
(6)从酸根离子结合氢离子难易的\程度分析.
解答 解:(1)亚磷酸是二元酸,亚磷酸与足量NaOH溶液反应,生成Na2HPO3,所以该反应方程式为:H3PO3+2OH-=HPO32-+2H2O,
故答案为:H3PO3+2OH-=HPO32-+2H2O;
(2)银离子还原为银单质,反应中银离子是氧化剂,氧化产物的化学式为H3PO4,则H3PO3是还原剂,根据转移电子守恒,n(Ag+)=n(H3PO3)×(5-3),即n(Ag+):n(H3PO2)=2:1,
故答案为:2:1.
(3)H3PO3?H++H2PO3-
起始浓度 0.10 0 0
反应浓度 2.5×10-2 2.5×10-2 2.5×10-2
平衡浓度0.10-2.5×10-2 2.5×10-2 2.5×10-2
电离平衡常数K=$\frac{c({H}^{+})•c({H}_{2}P{O}_{3}^{-})}{c({H}_{3}P{O}_{3})}$=$\frac{2.5×1{0}^{-2}×2.5×1{0}^{-2}}{0.10-2.5×1{0}^{-2}}$mol/L=8.3×10-3mol/L,
故答案为:8.3×10-3mol/L;
(4)向H3PO3溶液中滴加NaOH溶液至中性,根据电荷守恒得:c(Na+)=c(H2PO3-)+2c(HPO32-),在NaH2PO3溶液中质子守恒得;c(H+)+c(H3PO3)=c(HPO32-)+c(OH-)
故答案为:=;=;
(5)①产品室中HPO32-和氢离子结合生成亚磷酸,反应离子方程式为:HPO32-+2H+=H3PO3,
故答案为:HPO32-+2H+=H3PO3;
②得到1mol亚磷酸的同时,阴极室制得2molNaOH,得NaOH质量为80g
故答案为:80g;
(6)从酸根离子结合氢离子难易的\程度分析.H2PO4-结合H+比HPO42-难,故铵盐的分解温度:NH4H2PO4>(NH4)2HPO4,
故答案为:>.
点评 本题考查较为综合,涉及水解反应、氧化还原反应、电极反应式的书写等知识点,电极反应式的书写、有关平衡常数的计算是高考热点,应重点掌握,难度中等.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:多选题
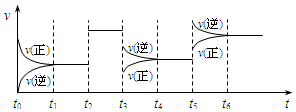 某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0,如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是
某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0,如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是| A. | t2时加入了催化剂 | B. | t3时降低了温度 | ||
| C. | t5时升高了温度 | D. | t4~t5时间内转化率一定最低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b>c>a | B. | b>a>c | C. | c>b>a | D. | a>b>c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol.L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 △H=+124kJ•mol-1
△H=+124kJ•mol-1| 化学键 | C-H | C-C | C═C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | x | 436 |
 △H2>0
△H2>0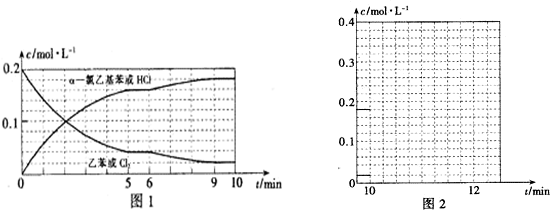
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
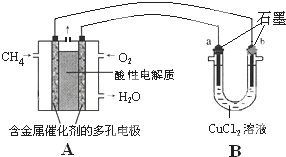 (3)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图.
(3)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 反应物 | 起始温度t1/℃ | 终了温度t2/℃ | 中和热/kJ•mol-1 |
| A.1.0mol/L HCl溶液50mL、1.1mol/L NaOH溶液50mL | 13.0 | 19.8℃ | △H1 |
| B.1.0mol/L HCl溶液50mL、1.1mol/L NH3•H2O溶液50mL | 13.0 | 19.3℃ | △H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
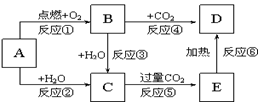 图示中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物,它们的焰色反应均为黄色.请填写下列空白:
图示中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物,它们的焰色反应均为黄色.请填写下列空白:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com