
| A. | 要使AlCl3溶液中Al3+全部沉淀出来可使用氨水 | |
| B. | 某气体能使品红溶液褪色,该气体一定为SO2 | |
| C. | 用饱和NaHCO3溶液除去混在Cl2中的HCl气体 | |
| D. | 用Cl2除去Fe2(SO4)3溶液中的少量FeSO4 |
分析 A、Al3+转化为不溶于水的物质是Al(OH)3,Al(OH)3具有两性,既能和强酸反应又能和强碱反应,要使AlCl3溶液中的Al3+完全沉淀,选取试剂时就不能选强碱,只能是弱碱;
B、Cl2、Na2O2、H2O2等氧化性;SO2与品红发生化合反应褪色;
C、氯水与碳酸氢钠溶液也反应,而实验室是用饱和食盐水除去混在Cl2中的HCl气体;
D、通入氯气,FeSO4与氯气反应生成氯化铁溶液,所以会引入新的杂质.
解答 解:A、Al3+转化为不溶于水的物质是Al(OH)3,Al(OH)3具有两性,既能和强酸反应又能和强碱反应,要使AlCl3溶液中的Al3+完全沉淀,选取试剂时就不能选强碱,只能是弱碱,所以要使AlCl3溶液中Al3+全部沉淀出来可使用弱碱氨水,故A正确;
B、Cl2、Na2O2、H2O2等氧化性;SO2与品红发生化合反应褪色,所以不一定是二氧化硫,故B错误;
C、氯水与碳酸氢钠溶液也反应,而实验室是用饱和食盐水除去混在Cl2中的HCl气体,故C错误;
D、通入氯气,FeSO4与氯气反应生成氯化铁溶液,所以会引入新的杂质,可用加硫酸酸化的H2O2,能把FeSO4氧化为Fe2(SO4)3,故D错误;
故选A.
点评 本题考查了物质的分离、提纯,为高考常见题型,侧重于学生的分析能力的考查,注意把握物质的性质,除杂时要注意不能引入新的杂质,难度不大.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | H2O与BeCl2为角形(V形) | B. | CS2与SO2为直线形 | ||
| C. | BF3与PCl3为三角锥形 | D. | SO3与CO${\;}_{3}^{2-}$为平面三角形 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2只作氧化剂 | |
| B. | 2 mo l FeSO4发生反应时,反应中共有8 mol电子转移 | |
| C. | FeSO4为还原剂 | |
| D. | 铁元素被还原,氧元素被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取蒸馏水时,温度计的水银球应插入蒸馏烧瓶的溶液中 | |
| B. | 稀释浓硫酸时,应将水缓缓地加入浓硫酸中并不断搅拌 | |
| C. | 萃取水中碘单质时,萃取剂的密度应大于水的密度 | |
| D. | 分液时,下层液体需从分液漏斗下口流出,上层液体应从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸钠可用于制备硅胶和木材防火剂等 | |
| B. | 氧化铝熔点高可用作耐火材料 | |
| C. | 晶体硅可用于制造光导纤维 | |
| D. | 氯水和臭氧可用于自来水消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2FeO4中Fe为+6价,具有强氧化性,能杀菌消毒 | |
| B. | 反应①中,NaCl是氧化产物 | |
| C. | 反应①为氧化还原反应,反应②为复分解反应 | |
| D. | 若有2mol FeCl3发生反应,转移电子的物质的量为6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
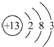 ,下列关于该元素的说法中,错误的是( )
,下列关于该元素的说法中,错误的是( )| A. | 它是一种金属元素 | B. | 它的阳离子有10个质子 | ||
| C. | 它的阳离子带3个单位正电荷 | D. | 其原子核外有13个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应的判断依据是看反应前后元素化合价是否发生变化 | |
| B. | 根据是否只含一种元素将物质分为纯净物和混合物 | |
| C. | 根据水溶液是否能导电将化合物分为电解质和非电解质 | |
| D. | 根据是否有丁达尔现象将分散系分为溶液和胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com