
分析 (1)铜和浓HNO3反应随反应的进行硝酸浓度变稀,产生气体是一氧化氮和二氧化氮的混合气体,根据得失电子守恒分析解答;
(2)根据电子守恒计算,已知HNO3$\stackrel{Cu}{→}$NO、NO2$\stackrel{氧气}{→}$HNO3,反应前后HNO3的物质的量不变,而化合价变化的只有铜和氧气,则Cu失去电子数目等于O2得到电子的数目,以此进行计算.
解答 解:(1)设气体中NO2、NO的物质的量分别为x、y.
气体的体积为6.72L,则$x+y=\frac{6.72L}{22.4L/mol}$,有得失电子守恒有:$x+3y=\frac{12.8g}{64g/mol}×2$;
解之得x=0.25 mol; y=0.05 mol;
则:NO20.25 mol,NO 0.05mol,
答:集到的气体中NO20.25 mol,NO 0.05mol;
(2)根据铜失去的电子等于氧气得到的电子,则有:${V_{O_2}}=2×\frac{12.8g}{64g/mol}$÷4×22.4 L/mol=2.24 L,答:O2在标准状况下的体积为2.24 L.
点评 本题考查氧化还原反应电子转移数目的计算,本题难度不大,根据HNO3$\stackrel{Cu}{→}$NO、NO2$\stackrel{氧气}{→}$HNO3,得出Cu失去电子数目等于O2得到电子的数目是解答本题的关键.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③⑥⑦⑧ | B. | ①②③④⑦ | C. | ①④⑥⑦ | D. | ①④⑥⑦⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素Y的最高正化合价为+6 | B. | 离子半径的大小顺序为W>Q>Z>X>Y | ||
| C. | 工业上用电解法冶炼Z单质 | D. | 元素Q的含氧酸的酸性一定比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
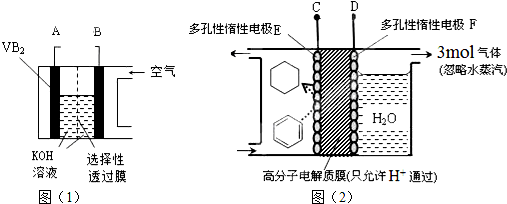
| A. | 整套装置工作时的连接为A连接D、B连接C | |
| B. | VB2极发生的电极反应为:2VB2+22OH--22e-═V2O5+2B2O3+11H2O | |
| C. | 电极F产生3mol气体时电极E得到的氧化产物为2mol | |
| D. | 储氢装置工作时,右侧电极区的pH值减小2×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ②④ | C. | ①③⑤ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
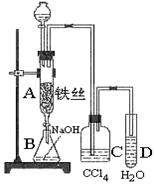 某化学课外小组用图装置使苯与液溴反应.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用图装置使苯与液溴反应.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com