
【题目】以黄铁矿为原料制备硫酸会产生大量的废渣,合理利用废渣可以减少环境污染,变废为宝。工业上,可利用废渣(含Fe2+、Fe3+的硫酸盐及少量 CaO和MgO)制备高档颜料铁红(Fe2O3) 和回收(NH4)2SO4,具体生产流程如下。
已知:铵黄铁矾的化学式为(NH4)2Fe6(SO4)4(OH)12。
(1)在废渣溶解操作时,应选用________溶解(填字母)。
A.氨水 B.氢氧化钠溶液 C.盐酸 D.硫酸
(2)为了提高废渣溶解时的浸取效率,可采用的措施有哪些?___________________(写出一点即可)。
(3)物质A 是一种氧化剂,工业上一般选用空气,其理由是___________。氧化过程中发生反应的离子方程式为_________________。
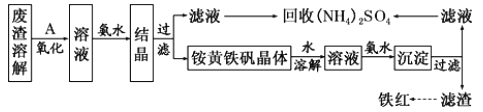
(4)根据下图有关数据,你认为工业上氧化操作时应控制的最佳温度和pH是:______。
(5) 铵黄铁矾中 可能混有的 杂质有 Fe(OH)3、____________。 铵黄铁矾与氨水反应的离子方程式为______________。
【答案】 D 将废渣粉碎、加热、搅拌等 原料易得,成本低, 不产生污染,不引入杂质 4Fe2++O2+4H+===4Fe3++2H2O 80℃ ,pH=1.5 Ca(OH)2、Mg(OH)2、CaSO4 Fe3++3NH3H2O=Fe(OH)3↓+3NH4+
【解析】废渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO),将废渣溶解,溶解时加入的物质能溶解废渣但不能引进杂质;然后向溶液中加入A,A具有氧化性,能氧化亚铁离子但不能引进新的杂质且原料易得、成本低,应为空气中的氧气,然后向溶液中加入氨水,溶液中硫酸铁和氨水反应生成铵黄铁矾,同时溶液中镁离子、钙离子形成氢氧化钙、氢氧化镁、硫酸钙等会结晶析出,采用过滤方法分离得到铵黄铁矾和滤液;将滤液蒸发浓缩回收硫酸铵;
将铵黄铁矾溶于水得到溶液,然后向溶液中加入氨水,得到氢氧化亚铁沉淀,然后过滤得到滤渣,将滤渣加热得到铁红,(1)溶解废渣的溶剂能溶解废渣且不能引进新的杂质;(2)提高废渣的浸取率可以粉粹、搅拌、升温等措施;(3)A是氧化剂,具有氧化性,能氧化亚铁离子,但不能引进新的杂质且原料易得、成本低;亚铁离子在酸性溶液中被氧化为铁离子;
(4)依据图象分析,亚铁离子的氧化率最高是溶液温度为80℃,pH为1.5;(5)向溶液中加入氨水,溶液中硫酸铁和氨水反应生成铵黄铁矾,同时溶液中镁离子、钙离子形成氢氧化钙、氢氧化镁、硫酸钙等会结晶析出。
(1)溶解废渣的溶剂能溶解废渣且不能引进新的杂质,氨水和NaOH不溶解CaO和MgO,稀盐酸能溶解废渣但引进杂质,稀硫酸能溶解废渣且不引进新的杂质,答案选D;(2)为了提高废渣的浸取率,可采用的措施有:将废渣粉碎、加热、搅拌等;(3)A是氧化剂,具有氧化性,能氧化亚铁离子,但不能引进新的杂质且原料易得、成本低,氯气和二氧化锰都具有氧化性,但引进新的杂质且成本高,所以选取空气,氧化过程中发生反应的离子方程式为:4Fe2++O2+4H+═4Fe3++2H2O;(4)分析图象可知在80℃时 溶液PH=1.5,此时亚铁离子的氧化率在90%以上,时间在4h左右;(5)分析可知铵黄铁矾中可能混有的杂质有Fe(OH)3、Ca(OH)2、Mg(OH)2、CaSO4;铵黄铁矾与氨水反应是铁离子与氨水反应生成氢氧化铁和铵盐,反应的离子方程式为Fe3++3NH3H2O=Fe(OH)3↓+3NH4+。


科目:高中化学 来源: 题型:
【题目】a、b、c、d、e五种短周期元素的原子半径和最外层电子数之间的关系如图所示:下列说法正确的是
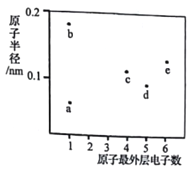
A. 离子半径:b>d
B. 沸点:a与d形成的化合物>a与c形成的化合物
C. a与b、c、d、e均可形成共价化合物
D. e的含氧酸可能既有氧化性又有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用工业废料(主要含MgCO3、FeCO3和Al2O3等)回收镁的工艺流程如下:
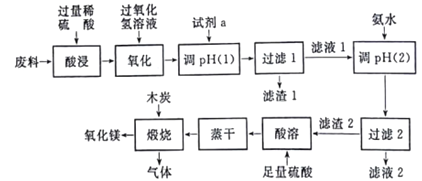
(1)酸浸过程中采用粉碎原料、加热、搅拌、适当增大硫酸的浓度等措施的目的是______;用过氧化氢溶液氧化时,发生的反应离子方程式为_________。
(2)为了不影响产品的纯度,试剂a应选择______(填编号)。
A.CuO B.Ca(OH)2 C.MgCO3 D.氨水
在用试剂a调节pH过程中,先生成的沉淀是______;当pH=5时,滤液1中Al3+和Fe3+的物质的量浓度之比为________(已知:298K时,Ksp[Al(OH)3]=3.0×10-34,Ksp[Fe(OH)3]=4.0×10-38)。
(3)写出生成滤渣2的离子方程式____________。
(4)煅烧过程存在以下反应:
2MgSO4+C=2MgO+2SO2↑+CO2↑ MgSO4+C=MgO+SO2↑+CO↑ MgSO4+3C=MgO+SO2↑+3CO↑
为测定煅烧后产生的气体中各组分含量,进行如下实验:将气体冷却至标准状况后取22.4mL气体,经Ba(OH)2溶液充分吸收,剩余7mL气体(标准状况);所得沉淀用足量硝酸溶解,再经过滤、洗涤、干燥、称量得沉淀0.1165g。则混合气体中SO2、CO2、CO体积比为_____(填最简整数比)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于SO2的叙述正确的是( )
A.SO2是无色无味有毒的气体B.SO2有毒,不能做食品添加剂
C.SO2不溶于水D.SO2与NaOH反应能生成Na2SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列区别浓硫酸和稀硫酸的方法中既简单又可靠的是( )
A.与石蕊溶液反应B.与铜片反应
C.加入锌片看是否有气体产生D.用玻璃棒各蘸少许涂在纸上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: ①25℃时弱电解质电离平衡数;Ka(CH3COOH)═1.8×10﹣5 , Ka(HSCN)═0.13;
难溶电解质的溶度积常数:KSD(CaF2)═1.5×10﹣10
②25℃时,2×l0﹣3molL﹣1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c (HF)、C(F﹣)与溶液pH的变化关系,如图1所示: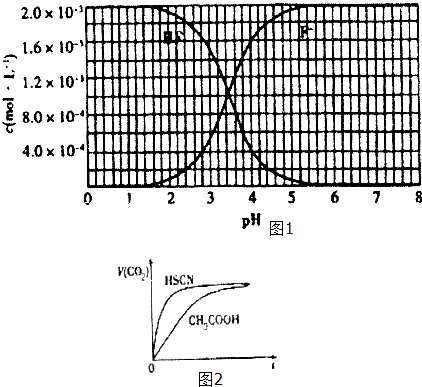
请根据以下信息回答下列问题:
(1)25℃时,将20mL 0.10molL﹣1CH3COOH溶液和20mL 0.l molL﹣1 HSCN溶液分别 与20mL 0.10molL﹣1NaHCO3 溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示: 反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 ,
反应结束后所得两溶液中,C(CH3COO﹣)c(SCN﹣)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka≈ .
(3)4×10﹣3molL﹣1HF溶液与4×10﹣4molL﹣1CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
B元素原子的核外p电子数比s电子数少1 |
C原子的第一至第四电离能分别是:I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
D原子核外所有p轨道全满或半满 |
E元素的主族序数与周期数的相差4 |
F 是前四周期原子电子排布图中单电子数最多的元素 |
G在周期表的第十一列 |
(1)B基态原子的电子排布式为;F基态原子的价电子排布式为;G基态原子的最外层电子排布图为 .
(2)C和与其左右相邻元素原子的第一电离能由大到小的顺序是(用元素符号填空).
(3)B、D的电负性相对大小:BD(用“大于”、“小于”或“等于”填空).
(4)以上六种元素中,位于s区的有种,位于p区的有种.
(5)DE3的电子式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用如图所示装置制取少量乙酸乙酯.请回答下列问题: 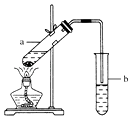
(1)试管a中需加入浓硫酸、乙酸各2mL,乙醇3mL,应该先加入 , 再加入 , 最后加入 .
(2)试管a中发生反应的化学方程式是 , 反应类型是 , 通常加入几片碎瓷片,其作用是 .
(3)试管b中加入饱和Na2CO3溶液,其作用是 .
(4)反应结束后,振荡试管b,静置.观察到的现象 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com