
| A. | HCl | B. | NaOH | C. | Na 2SO 4 | D. | NaCl |
分析 A.电解盐酸,发生反应:2HCl$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑,溶液中HCl浓度降低;
B.电解NaOH溶液,发生反应:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,溶液中NaOH浓度增大;
C.电解Na2SO4溶液,发生反应:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,Na2SO4浓度增大,但Na2SO4溶液为中性;
D.电解NaCl溶液,发生反应:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,有NaOH生成.
解答 解:A.电解盐酸,发生反应:2HCl$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑,溶液中HCl浓度降低,酸性减弱,溶液pH增大,故A错误;
B.电解NaOH溶液,发生反应:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,溶液中NaOH浓度增大,碱性增强,溶液pH增大,故B错误;
C.电解Na2SO4溶液,发生反应:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,Na2SO4浓度增大,但Na2SO4溶液为中性,溶液pH不变,故C正确;
D.电解NaCl溶液,发生反应:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,有NaOH生成,碱性增强,溶液pH增大,故D错误,
故选:C.
点评 本题考查电解原理,难度不大,关键是明确离子放电顺序及电极反应,有利于基础知识的巩固.


科目:高中化学 来源: 题型:选择题

| A. | 反应物的总键能量低于生成物的总键能 | |
| B. | 该反应是放热反应 | |
| C. | 当A的正反应速率与C的逆反应速率相同时处于平衡状态 | |
| D. | 当A、B、C、D的浓度相同时,反应处于平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| 离子 | Cu2+ | Al3+ | NO3- | Cl- |
| 物质的量浓度/ (mol•L-1) | 2 | 1 | 4 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
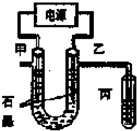 CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu(H2O)42+(蓝色)+4Cl-?CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电.下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝.回答下列问题:
CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu(H2O)42+(蓝色)+4Cl-?CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电.下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂化主要得到乙烯 | |
| B. | 石油分馏是化学变化,可得到汽油、煤油 | |
| C. | 煤的干馏是化学变化,可以得到出炉煤气、煤焦油和焦炭 | |
| D. | 煤的气化是物理变化,是高效、清洁地利用煤的途径 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
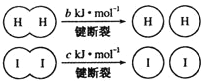
| A. | 向密闭容器中加入1 mol H2(g)和2mol I2(g),充分反应后放出的热量有可能等于a kJ | |
| B. | 反应物的总能量低于生成物的总能量 | |
| C. | 断开2 mol H-I键所需能量约为(c+b+a)kJ | |
| D. | 断开1 mol I-I键的同时形成2mol H-I键,说明反应已达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
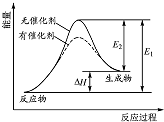
| A. | 该反应的反应物总能量高于生成物总能量 | |
| B. | 使用催化剂可以增大该反应的反应热 | |
| C. | 该化学反应的反应热为E1,且反应放热 | |
| D. | 化学反应在物质变化的同时,必然伴随能量变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com