
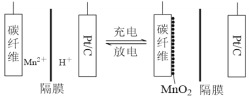
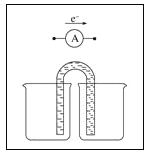
【题目】一种新型锰氢二次电池原理如图所示。该电池以MnSO4溶液为电解液,碳纤维与Pt/C分别为电极材料,电池的总反应为Mn2++ 2H2O![]() MnO2 + 2H++ H2↑。下列说法错误的是
MnO2 + 2H++ H2↑。下列说法错误的是
A. 充电时,碳纤维电极做阳极
B. 充电时,碳纤维电极附近溶液的pH增大
C. 放电时,电子由Pt/C电极经导线流向碳纤维电极
D. 放电时,正极反应式为MnO2 + 4H++ 2e-=Mn2++ 2H2O
【答案】B
【解析】
新型电池放电时是原电池,碳纤维表面MnO2发生还原反应生成Mn2+,为正极;充电时是电解池,碳纤维表面Mn2+发生氧化反应生成MnO2,为阳极。
A.充电时是电解池,碳纤维表面Mn2+发生氧化反应生成MnO2,则碳纤维电极做阳极,故A正确;
B.充电时,碳纤维电极发生的电极反应为Mn2++ 2H2O-2e-= MnO2 + 4H+,附近溶液的pH减小,故B错误;
C.放电时是原电池,碳纤维为正极,Pt/C为负极,则电子由Pt/C电极经导线流向碳纤维电极,故C正确;
D.放电时,碳纤维表面MnO2发生还原反应生成Mn2+,电极反应式为MnO2 + 4H++ 2e-=Mn2++ 2H2O,故D正确;答案为B。


科目:高中化学 来源: 题型:
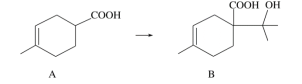
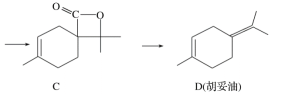
【题目】胡妥油(D)用作香料的原料,它可由A合成得到:
下列说法正确的是
A. 有机物B的分子式为C11H19O3
B. 有机物D分子中所有碳原子一定共面
C. 有机物C的所有同分异构体中可能有芳香族化合物存在
D. 1 mol有机物A中含有6.02×1023个双键.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下下列溶液中的指定离子与100 mL 3.9 mol/L Ba(NO3)2溶液所含NO3-物质的量浓度相同的是
A.390 mL 0.1 mol/L MgCl2溶液中的Cl-
B.200 g 浓度为26%,密度为1.2g/mLNaOH溶液中的OH-
C.50 mL 7.8 mol/L Al2(SO4)3溶液中的SO42-
D.200 mL 3.9 mol/L CaCl2溶液中的Ca2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期元素的原子序数依次增大。已知A、C、F位于同一周期,三种元素原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。试回答:
(1)写出下列元素的元素符号:
A_____,C_____,D_____,E__________
(2)用电子式表示B、F形成的化合物_____。
(3)A、C两种元素最高价氧化物的水化物之间反应的化学方程式为_____, C、F两种元素最高价氧化物的水化物之间反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,盐桥中装有饱和![]() 溶液。下列叙述中正确的是
溶液。下列叙述中正确的是
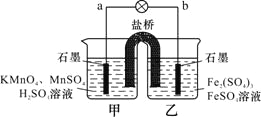
A. 甲烧杯中溶液的![]() 逐渐减小 B. 乙烧杯中发生还原反应
逐渐减小 B. 乙烧杯中发生还原反应
C. 外电路的电流方向是从![]() 到
到![]() D. 电池工作时,盐桥中的
D. 电池工作时,盐桥中的![]() 移向甲烧杯
移向甲烧杯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业上使用![]() 溶液蚀刻铜箔制造印刷电路板。在该制备工艺中,为了实现资源再生,减少污染,某兴趣小组提出废液处理和资源回收的过程如下:
溶液蚀刻铜箔制造印刷电路板。在该制备工艺中,为了实现资源再生,减少污染,某兴趣小组提出废液处理和资源回收的过程如下:
Ⅰ.向废液中投入过量铁屑,充分反应后分离出固体和滤液;
Ⅱ.向滤液中加入一定量石灰水,调节溶液![]() ,同时鼓入足量的空气。
,同时鼓入足量的空气。
已知:Ksp[Fe(OH)3]=4×10-38,回答下列问题:
(1)![]() 蚀刻铜箔反应的离子方程式为______;过程Ⅰ加入铁屑的主要作用是______
蚀刻铜箔反应的离子方程式为______;过程Ⅰ加入铁屑的主要作用是______
(2)过程Ⅱ中鼓入足量的空气发生反应的化学方程式为______
(3)过程Ⅱ中调节溶液的![]() 为5,金属离子浓度为______。(列式计算)
为5,金属离子浓度为______。(列式计算)
(4)另一兴趣小组将制造印刷电路板![]() 蚀刻铜箔的反应设计成一个原电池。请将方框中实验装置图补充完整,并作相应标注(标出电极材料、电解质溶液)。限选材料:
蚀刻铜箔的反应设计成一个原电池。请将方框中实验装置图补充完整,并作相应标注(标出电极材料、电解质溶液)。限选材料:![]() ,
,![]() ,
,![]() ,
,![]() :铜片,铁片,锌片,石墨和导线。
:铜片,铁片,锌片,石墨和导线。
(5)废旧印刷电路板经粉碎分离能得到非金属粉末和金属粉末,也可回收利用实现资源再生,减少污染。印刷电路板的金属粉末用![]()
![]() 和
和![]()
![]() 的混合溶液处理,溶出印刷电路板金属粉末中的铜。控制其他条件相同时,测得不同温下铜的平均溶解速率(见下表)。
的混合溶液处理,溶出印刷电路板金属粉末中的铜。控制其他条件相同时,测得不同温下铜的平均溶解速率(见下表)。
温度 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜平均溶解速率 |
|
|
|
|
|
|
|
①当温度高于![]() 时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______。
时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______。
②在提纯后的![]() 溶液中加入一定量的
溶液中加入一定量的![]() 和
和![]() 溶液,加热,生成
溶液,加热,生成![]() 沉淀。制备
沉淀。制备![]() 的离子方程式是______。
的离子方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近有科学家研发了一种新型锂空气电池,结构如下图所示。已知:①电解质由离子液体(离子能够自由移动,非溶液)和二甲基亚砜[(CH3)2SO]混合制成,可促进过氧化锂生成;②碳酸锂薄层的作用是让锂离子进入电解质,并阻止其它化合物进入该电极;③二硫化钼起催化作用。该装置工作时,下列叙述不正确的是

A. 放电时,a极发生氧化反应
B. 放电时的总反应为:2Li+O2=Li2O2
C. 充电时,Li+在电解质中由b极移向a极
D. 充电时,b极的反应式:Li2O2+2e-=2Li+O22-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表、元素周期律及其相关应用叙述正确的是( )
A.原子的种类和元素的种类一样多
B.在现行元素周期表中,所含元素种数最多的是ⅢB族
C.可以在元素周期表金属与非金属分界处寻找催化剂
D.IA族的元素全部是金属元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com