
【题目】科学家研究以太阳能为热源分解Fe3O4,最终循环分解水制H2,其中一步重要反应为:2Fe3O4(s)![]() 6FeO(s)+O2(g) △H=a kJ/mol。在一定压强下, Fe3O4的平衡转化率随温度变化的a(Fe3O4)―T曲线如图所示。下列有关说法不正确的是
6FeO(s)+O2(g) △H=a kJ/mol。在一定压强下, Fe3O4的平衡转化率随温度变化的a(Fe3O4)―T曲线如图所示。下列有关说法不正确的是
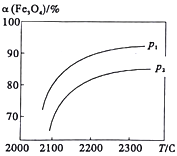
A. a>0
B. 压强p1>p2
C. 升高温度,该反应的平衡常数增大
D. 将体系中O2分离出去,能提高Fe3O4的转化率
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g) ![]() 2Z(g)+W(s)ΔH<0,下列叙述正确的是( )
2Z(g)+W(s)ΔH<0,下列叙述正确的是( )
A. 达到平衡时,反应速率v正(X)=2v逆(Z)
B. 平衡常数K值越大,X的转化率越大
C. 达到平衡后降低温度,平衡向逆反应方向移动
D. 达到平衡后,增大压强有利于该反应平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需480mL1.0mol/LNaOH溶液,若用固体NaOH配制,则应选择的容量瓶规格为
A. 480mL B. 1000mL C. 100mL D. 500mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于Na2CO3和NaHCO3的说法中,不正确的是
A. 焰色反应均为黄色
B. 溶解度:Na2CO3>NaHCO3
C. 可以用加热的方法除去Na2CO3固体中的NaHCO3杂质
D. 物质的量相同的两种固体分别与足量盐酸反应,Na2CO3产生的二氧化碳多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)2NO2(g)△H=+57kJmol﹣1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示.下列说法正确的是
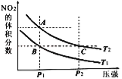
A. A、C两点的反应速率:A>C
B. A、C两点气体的颜色:A深,C浅
C. A、B两点气体的平均相对分子质量:A>B
D. B、C两点化学平衡常数:B<C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铋酸钠(NaBiNO3)检验溶液中的Mn2+,反应方程式为:4MnSO4+10NaBiO3+14H2SO4═4NaMnO4+5Bi2(SO4)3+3Na2SO4+口,下列说法不正确的是
A. 口内的物质为水,配平系数为14。
B. 若生成1mol NaMnO4,则转移5mole-
C. 反应方程式中的硫酸可换为盐酸
D. 溶液中有Mn2+的现象是溶液变为紫红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化六氨合钴(Ⅲ)是一种重要的化工产品,实验中采用H2O2作氧化剂,在大量氨和氯化铵存在下,选择活性炭作为催化剂将Co(Ⅱ)氧化为Co(Ⅲ),来制备三氯化六氨合钴(Ⅲ)配合物,反应式为:2(CoCl2·6H2O)+10NH3+2NH4Cl+H2O2![]() 2[Co(NH3)6]Cl3+14H2O
2[Co(NH3)6]Cl3+14H2O

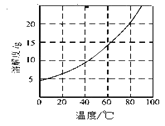
已知:①Co(NH3)6Cl3在不同温度下水中的溶解度曲线如图。
②制备过程中可能用到的部分装置如下:
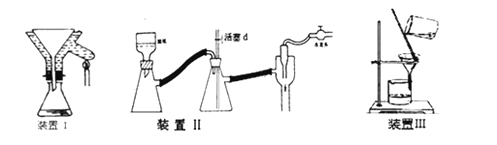
(1)原料NH4Cl的主要作用是_________;步骤④中要冷却至10℃再加入H2O2溶液,这样操作的目的:_____。
(2)步骤⑤中保持60℃的加热方法是_____,恒温20分钟的目的是_____。
(3)步骤⑥是减压抽滤(见上图装置Ⅱ),当抽滤完毕或中途停止抽滤时,防自来水倒吸入抽滤瓶最佳的正确操作是_____。
(4)操作A的名称为_____。若操作过程中,发现漏斗尖嘴处有少量晶体析出,处理方法是_________。
(5)步骤⑨进行洗涤时要用到两种试剂,应该依次用_____(填序号)洗涤。
A. 饱和氯化钠溶液 B. 无水乙醇 C. 浓盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com