
 化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图所示.据图回答:
化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图所示.据图回答:分析 (1)由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极;
阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知有氢离子参与反应且有水生成;
(2)转移5mol电子时,阳极(阳极反应为H2O失电子氧化为O2和H+)消耗2.5mol水,产生5molH+进入阴极室,阳极室质量减少45g;阴极的电极反应式为2NO3-+6H++10e-=N2↑+6OH-,转移5mol电子,阴极室中放出0.5molN2(14g),同时有5molH+(5g)进入阴极室.
解答 解:(1)由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极;
在阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知有H2O参与反应且有水生成,所以阴极上发生的电极反应式为:2NO3-+12H++10e-=N2+6H2O,故答案为:A;2NO3-+12H++10e-=N2+6H2O;
(2)转移5mol电子时,阳极(阳极反应为H2O失电子氧化为O2和H+)消耗2.5mol水,产生5molH+进入阴极室,阳极室质量减少45g;阴极的电极反应式为2NO3-+6H++10e-=N2↑+6OH-,转移5mol电子,阴极室中放出0.5molN2(14g),同时有5molH+(5g)进入阴极室,因此阴极室质量减少9g,故膜两侧电解液的质量变化差(△m左-△m右)=45g-9g=36g,
故答案为:36.
点评 本题考查电解原理、电极反应式书写、电解计算等知识点,(2)要注意该题中阴极室有氢离子进入,易漏掉,为易错点,题目难度中等,侧重于考查学生的分析能力和计算能力.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:多选题
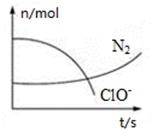 某反应体系中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种微粒,反应过程中测得ClO-和N2的物质的量随时间的变化如图所示.有关判断正确的是( )
某反应体系中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种微粒,反应过程中测得ClO-和N2的物质的量随时间的变化如图所示.有关判断正确的是( )| A. | 氧化剂是ClO-,还原产物是HCO3- | |
| B. | 反应体系中反应物与生成物各有三种微粒 | |
| C. | 氧化剂与还原剂的物质的量之比为5:2 | |
| D. | 生成2.24L N2(标准状况)时转移电子0.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 当滴入20mL NaOH溶液时:2c(SO42-)=c(NH3•H2O)+c(NH4+) | |
| B. | 当滴入30mL NaOH溶液时(pH>7):c(NH4+)>c(NH3•H2O)>c(OH-)>c(H+) | |
| C. | 当溶液呈中性时:c(NH4+)>c(SO42-)>c(Na+)>c(H+)=c(OH-) | |
| D. | 整个反应过程中:c(H+)+c(Na+)+c(NH4+)=c(OH-)+2c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5 g甲基所含有的电子数目为0.9NA | |
| B. | 在1L0.1 mol•L-1Na2S溶液中,阴离子总数大于0.1NA | |
| C. | 78g Na2O2与足量CO2完全反应,转移的电子总数为NA | |
| D. | 在KIO3+6HI=KI+3I2+3H2O反应中,每生成3 molI2,则转移6NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2g | B. | 5.6g | C. | 2.8g | D. | 1.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 太阳能光电池的主要成份是单质硅 | |
| B. | 核电站泄漏的放射性碘-131(${\;}_{53}^{131}$I)、铯-137(${\;}_{55}^{137}$Cs)互称同位素 | |
| C. | 汽车尾气污染物中含有的氮氧化物,是汽油不完全燃烧造成的 | |
| D. | 某雨水样品放置一段时间后pH由4.68变为4.28,是因为吸收了CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上用FeCl3溶液吸收废气中的H2S气体,离子方程式为:Fe3++H2S=Fe2++S↓+2H+ | |
| B. | 在0.1 mol/L的AlCl3溶液中,Na+、K+、SO42-、HCO3-均可大量共存 | |
| C. | 常温下pH=4的NaHC2O4溶液中:c(H2C2O4)>c(C2O42-) | |
| D. | 已知25℃时NH4CN溶液显碱性,则25℃时的电离平衡常数K(NH3•H2O)>K(HCN) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后生成NO的体积为28 L | B. | 所得溶液中c(Fe2+):c(Fe3+)=1:1 | ||
| C. | 所得溶液中c(NO3-)=2.75 mol/L | D. | 所得溶液中的溶质只有FeSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
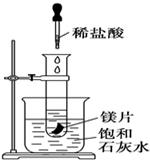 如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:
如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com