
 2SO3
2SO3| 0.004 |
| 0.005 |
| 0.004 mol/L |
| 10min |
| 0.001+ 0.001+0.004 |
| 0.005+ 0.003 |
| 0.004 |
| 0.001+0.001+0.004 |
| c2(SO3) |
| c2(SO2)×c(O2) |
| 0.004 2 |
| 0.0012×0.001 |


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
| A、MgF2 |
| B、MgCl2 |
| C、CaCl2 |
| D、CaBr2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
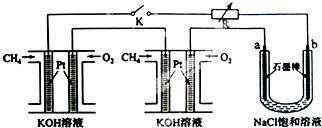
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实 验 用 品 | 溶 液 温 度 | 中和热 △H | |||
| t1 | t2 | ||||
| ① | 50mL0.55mol?L-1NaOH | 50mL.0.5mol?L-1HCl | 20℃ | 23.3℃ | |
| ② | 50mL0.55mol?L-1NaOH | 50mL.0.5mol?L-1HCl | 20℃ | 23.5℃ | |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| n+m | 2 | |
| VSEPR理想模型 | 正四面体 | |
| 价层电子对之间的理想键角 | 109°28′ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=0的溶液中:K+、ClO-、CH3CHO、SO42- |
| B、Ba(OH)2溶液中:K+、AlO2-、NO3-、Na+ |
| C、加人KSCN显血红色的溶液中:I-、NO3-、SO42-、Fe2+ |
| D、常温下由水电离出的C(H+)=10-10mol?L-1的溶液:Na+、Mg2+、SO42-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com