
����Ŀ���ҹ��й����ĺ����ߣ���ˮ�ۺ����ô��п�Ϊ����ˮ��Br������Ϊ65mgL��1���Ӻ�ˮ����ȡ��Ĺ�ҵ�������£�
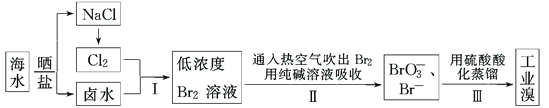
��1�����ϲ�������ѻ������̬���壬������ֽ�֮ת��ɻ���̬���壬��Ŀ���ǣ�_______��
��2�������ͨ���ȿ�����ˮ��������Br2�����������___������ţ���
A�������� B����ԭ�� C���ӷ��� D����ʴ��
��3���������̢����漰�����ӷ�Ӧ���£��������淽���������ʵ��Ļ�ѧ��������
___Br2+___CO32���T___BrO3��+___Br��+___CO2��
��4�����������д�������������Ҳ�����ö�������ˮ��Һ���գ�������������������д�����������������ˮ��Һ��Ӧ�����ӷ���ʽ��___________��
��5��ʵ���Ҵ���ˮ�з�����廹�������ܼ���ȡ�������п������������ȡ������____������ţ���
A���Ҵ� B�����Ȼ�̼ C���ѻ����� D����
���𰸡� ������Ԫ�� C 3 3 1 5 3 SO2+Br2+2H2O=4H++2Br��+SO42�� BD
���������������̷�����֪����ˮͨ��һ�����������õ���ˮ��±ˮ��±ˮ��������������������Ϊ�����壬ͨ���ȿ�����ˮ��������Br2�����õ����嵥�ʵ��ӷ��ԣ�����������Һ����������Ӻ������ӷ���������ԭ��Ӧ�õ��嵥�ʣ���
��1����������ѻ������̬����Ũ�Ⱥܵͣ����ֱ�����������ɱ��ϸߣ������ڹ�ҵ��������������ѻ������̬���壬������ֽ�֮ת��ɻ���̬���壬��Ŀ���Ǹ�����Ԫ�أ����ͳɱ�����2�����ӷ��������ͨ���ȿ�����ˮ��������Br2������������Ļӷ��ԣ���ѡC����3���÷�Ӧ��BrԪ�ػ��ϼ���0�۱�Ϊ-1�ۡ�+5�ۣ�����С��������5���ٽ��ԭ���غ㡢����غ�÷���ʽΪ3Br2+3CO32-��BrO3-+5Br-+3CO2������4�����������д�������������Ҳ�����ö�������ˮ��Һ���գ������������������������������ˮ��Һ��Ӧ����������廯�⣬��Ӧ�Ļ�ѧ����ʽΪ��Br2+SO2+2H2O=2HBr+H2SO4�����ӷ���ʽΪ��SO2+Br2+2H2O��4H++2Br��+SO42������5����ȡ����ѡȡ������ȡ�������ʲ���Ӧ����������ȡ���е��ܽ�ȴ�����ԭ�ܼ��е��ܽ�ȡ���ȡ����ԭ�ܼ������ܣ�A���Ҵ�������ˮ�����Բ�������ȡ����A����B�����Ȼ�̼������ȡ��ѡȡ��������������ȡ����B��ȷ��C���ѻ����ͺ����ܷ����ӳɷ�Ӧ�����Բ�������ȡ����C����D����������ȡ��ѡȡ��������������ȡ����D��ȷ����ѡBD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͼʾ�ش����⣺
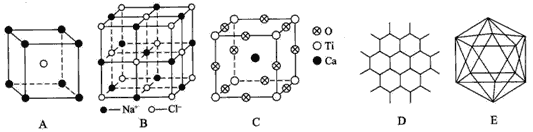
(1) Aͼ��ij���ӻ�����ľ������û����������������ӵĸ�������______��
(2)Bͼ��ʾNaCl�����һ��������һ��NaCl�����к�Na+��Cl-�ĸ�����Ϊ____________��
(3)��Ca��Ti��O�γɵ�ij���ѿ��;���ṹ��Cͼ���仯ѧʽΪ____________��
(4)ʯī����ṹ��Dͼ��ʾ��ÿһ�����������������ι��ɣ���ƽ��ÿһ������������ռ�е�̼ԭ������C-C����֮��Ϊ____________��
(5)ԭ�Ӿ�����Ļ����ṹ��Ԫ������12����ԭ����ɵ�����ʮ���壬��Eͼ�����к���20���ȱ������κ�һ����Ŀ�Ķ��ǣ�ÿ�������ϸ���1��ԭ�ӡ���������ԭ��ȡ�������е�������ԭ�ӣ��γ�B10N2����÷��ӽṹ��__________�֡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ�о���ѧϰС��Ϊ��ģ�ҵ���̴�Ũ���ĺ�ˮ����ȡҺ�壬��������֪��Br2�ķе�Ϊ59��������ˮ���ж��ԡ���������²������輰��Ҫʵ��װ�ã��г�װ����ȥ����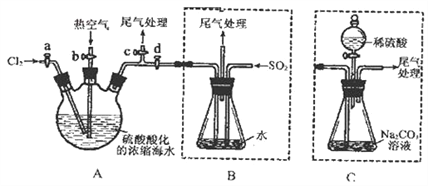
������A��B���رջ���b��d������a��c����A�л���ͨ������Ӧ������
�ڹر�a��c����b��d����A�й��������ȿ�����
�۽��в���ڵ�ͬʱ����B��ͨ������SO2��
�ܹر�b����a����ͨ��A��B�л���ͨ������Cl2��
�ݽ�B������Һ����������ռ�Һ�塣
��ش�
��1��������й����ȿ���������Ϊ_____________________________��
��2��������з�������Ҫ��Ӧ�����ӷ���ʽΪ______________________________��
��3����ʵ����β������______����ѡ����ĸ�����մ�����
a��ˮ b��Ũ���� c��NaOH��Һ d������NaCI��Һ
��4����ֱ������A��C�����в���ٺ͢ڣ���ַ�Ӧ������ƿ�еμ�ϡ���ᣬ�پ�����ݣ�Ҳ���Ƶ�Һ�塣�μ�ϡ����֮ǰ��C�з�Ӧ������NaBrO3�ȣ��÷�Ӧ�Ļ�ѧ����ʽΪ____________��
��5����Bװ����ȣ�����Cװ�õ��ŵ�Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��̽�����ؿ�������������ԭ������֤Cl2�����ʣ����ʵ�����£��г�װ����ȥ����ش��������⣺
I. Cl2���Ʊ���
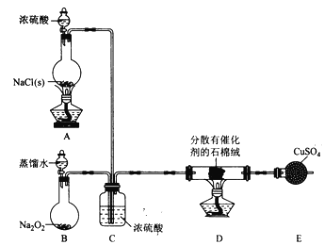
��1��װ��B�з�����Ӧ�Ļ�ѧ����ʽΪ____________________��
��2��װ��C�����ó������������_________________��
��3��װ�� E��ʢ��CuSO4����������Ϊ_______________����Ӧ��ʼ������ͭ��������װ��D�з�����Ӧ�Ļ�ѧ����ʽΪ_____________________��
II. Cl2���ʵ���֤��
��С����ʵ��I���Ƶõ�Cl2����ͼ��ʾװ�ã������ظ�ʹ�ã�������֤���﴿����Cl2��Ư���ԡ�ʪ���Cl2��Ư���ԡ�Cl�ķǽ�����ǿ��S
�������ϣ�
��PdCl2��Һ����COʱ�����ɽ������ʺ������������廯���
������CO2������ʵ�飻
�۸�ʵ�������£�C��Cl2����Ӧ��
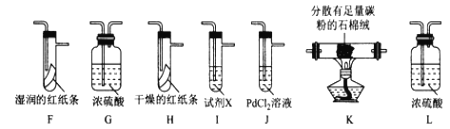
��4�������������ҵķ���װ�����ӵĺ���˳��ΪE��__��__��__��__��__��__��__��β������____________����װ����ĸ,��
��5���Լ�X������Ϊ____________��
��6��װ��J�з�����Ӧ�Ļ�ѧ����ʽΪ_________________��
��7�����ʵ��֤�����������Cl2�в���HC1��_______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ4A(s)��3B(g) ![]() 2C(g)��D(g)����2 min��B��Ũ�ȼ�����0.6 mol��L��1���Դ˷�Ӧ���ʵ���ȷ��ʾ�ǣ� ��
2C(g)��D(g)����2 min��B��Ũ�ȼ�����0.6 mol��L��1���Դ˷�Ӧ���ʵ���ȷ��ʾ�ǣ� ��
A. ��A��ʾ�ķ�Ӧ������0.8 mol��L��1��s��1
B. ��2 minĩʱ�ķ�Ӧ���ʣ��÷�Ӧ��B����ʾ��0.3 mol��L��1��min��1
C. �ֱ���B��C��D��ʾ��Ӧ�����ʣ����ֵ��3��2��1
D. ����2 min����B��C��ʾ�ķ�Ӧ���ʵ�ֵ������ͬ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����д���״���CH3OH���Ϳ�����ɵ�ȼ�ϵ�ص��������ҺΪKOHʱ�������缫��ӦʽΪ__________��������ӦʽΪ__________��
��2��NaCl�ۻ�ʱ���ƻ�����_____________���ƾ�����ˮʱ�ƻ�����___________��������Ӽ��������Լ������Ǽ��Լ������Ӽ�������������
��3��д���������ʵĵ���ʽ��
CO2_______________ Na3N _______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ҫ�ֲ����ҹ�����ɽ��С�˰���ȵأ����ϻ���Ҫ�ֲ����ҹ������������ϵ�������������ѧ����֪ʶ�жϣ�������֮������Ӧ�������滷�����뻪�ϻ���ȣ������������ʺ�����ռ�������Ըߣ��� ��
A. ֬�� B. ��ԭ C. ������ D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�����Ʒ�����������ε����ʽ���̽����
�ش��������⣺
�������Ʊ�
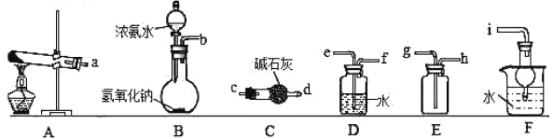
��1������Aװ���Ʊ�������д����Ӧ�Ļ�ѧ����ʽ_______________�����ռ�һƿ����İ�����ѡ����ͼ�е�װ�ã����ظ�ʹ�ã���������˳��Ϊ��a��___________��������������Сд��ĸ��ʾ����
��2����װ��B����Ũ��ˮ���������ƹ����ϣ�Ҳ���Ƶð���������÷����Ʊ�������ԭ ��________________________��
����ͼװ�ý��а���������ʵ�飨����1������2ʵ��ǰ�رգ���G��H�������������������
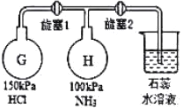
��3���ȴ�����I��Hƿ��������________________��ԭ����________________��һ��ʱ��ر�����1���ٴ������2��Hƿ��������_________��
�����ʵ�飬̽��ijһ���ض�һ�����ʵ���Ũ��NH4Clˮ��̶ȵ�Ӱ�졣
��ѡ�Լ���������NH4Cl���塢����ˮ���ձ�����ͷ�ιܡ���������ҩ�ס�������ƽ��pH�ơ��¶ȼơ�����ˮԡ�ۣ��ɿ����¶ȣ�
��4����������������ȱ��һ����Ҫ�IJ�����������������_______________��
��5�����������������Լ����������Ʋ�ʵ��Ŀ�ģ�̽��_______��NH4Clˮ��̶ȵ�Ӱ�졣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ذ�������ע�ⰲȫ������ʹ�����ը��Ŀ���ģ�����֮����Ȼ�������Ӳ�����ԭ��֮һ����ȼ���к��е�ʯ����ҵ�ϳ��õ�ʯ(��Ҫ�ɷ�ΪCaC2������ΪCaS��)��ˮ��Ӧ������Ȳ����
��1����ҵ�Ϻϳ�CaC2��Ҫ�������ȷ���
��֪��CaO(s)+3C(s)=CaC2(s)+CO(g) ��H=+464.1kJ��mol-1
C(s)+l/2O2(g)=CO(g) ��H=-110.5kJ��mol-1
��������������ɢ������ת���ʾ�Ϊ100��������¯�г���������ֻ��CO��Ϊά����ƽ�⣬ÿ����l molCaC2��ת�Ƶ��ӵ����ʵ���Ϊ_______��
��2����֪2000��ʱ���ϳ�̼���ƵĹ����л������漰�����·�Ӧ
CaO(s)+C(s) ![]() Ca(g)+CO(g) K1 ��H1=a KJ��mol-1
Ca(g)+CO(g) K1 ��H1=a KJ��mol-1
Ca(g)+2C(s) ![]() CaC2(s) K2 ��H2=b KJ��mol-1
CaC2(s) K2 ��H2=b KJ��mol-1
2CaO(s)+CaC2(s) ![]() 3Ca(g)+2CO(g) K3 ��H3=c KJ��mol-1
3Ca(g)+2CO(g) K3 ��H3=c KJ��mol-1
��K1=_______ (�ú�K2��K3�Ĵ���ʽ��ʾ)��c=_____(�ú�a��b�Ĵ���ʽ��ʾ)��
��3�����õ�ʯ������Ȳ���Ĺ����в�����H2S������ȡH2���������ֻ�����
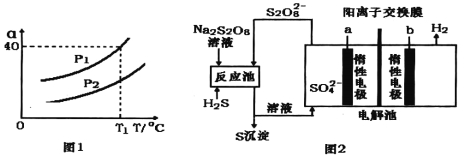
������������Ȳ��ȶ�����ȡ�����������Ϊ2L�ĺ����ܱ������У�H2S��ʼ���ʵ���Ϊ2mol���ﵽƽ���H2S��ת����![]() ���¶Ⱥ�ѹǿ�仯��ͼl��ʾ����ͼ����T1��ʱѹǿP1ʱ����Ϊ��̬����ƽ����ϵ��H2���������_____����ͼ֪ѹǿP1__P2(����ڡ���С�ڡ����ڡ�)��������______��
���¶Ⱥ�ѹǿ�仯��ͼl��ʾ����ͼ����T1��ʱѹǿP1ʱ����Ϊ��̬����ƽ����ϵ��H2���������_____����ͼ֪ѹǿP1__P2(����ڡ���С�ڡ����ڡ�)��������______��
�ڵ绯ѧ����ȡ������ԭ����ͼ2����д����Ӧ���з�����Ӧ�����ӷ���ʽ_____�����Ե缫a�Ϸ����ĵ缫��ӦʽΪ_______��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com