
| A、Cl- SO42- |
| B、Cl- NO3- |
| C、Cl- CO32- |
| D、Cl- OH- |


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
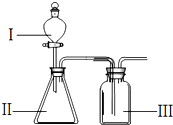
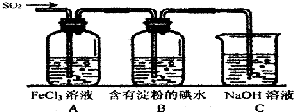 某兴趣小组探究SO2气体的性质,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体的性质,他们使用的药品和装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验内容 | 实验现象(填入下栏) |
如右图,在一个100ml烧杯中,加入3~4药匙Na2CO3,粉末,用一张比烧杯口稍大,中部呈凹形的铁丝网,凹部放入疏松的脱脂棉包裹着的过氧化钠,向烧杯中加入适量3mol?L-1盐酸,立即把铁丝网放在烧杯上. |
查看答案和解析>>
科目:高中化学 来源: 题型:
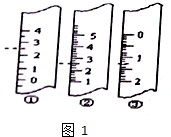 中用水稀释后转移到100mL容量瓶中定容,然后将稀释后的溶液倒入试剂瓶中.
中用水稀释后转移到100mL容量瓶中定容,然后将稀释后的溶液倒入试剂瓶中.
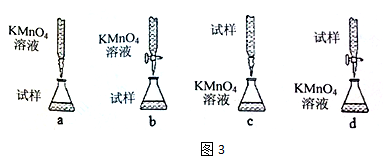
| 实验序号 | 待测样品溶液的体积/mL | 0.1000mol.L-1 KMnO4溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 24.98 |
| 2 | 25.00 | 1.56 | 29.30 |
| 3 | 25.00 | 1.00 | 26.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D四种短周期元素,且A、B为同周期元素,B、C同主族,B、C可形成共价化合物BC3和BC2,A、D同主族,A的原子结构示意图为:
A、B、C、D四种短周期元素,且A、B为同周期元素,B、C同主族,B、C可形成共价化合物BC3和BC2,A、D同主族,A的原子结构示意图为: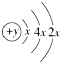
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡向正反应方向移动了 |
| B、物质A的转化率减少了 |
| C、物质B的质量分数减少了 |
| D、x>y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com