
���������绯������ͭ�����У���һ��Ҫ��Ӧ��CuFeS2+4Fe3+=Cu2++5Fe2++2S����Ӧ������������õ�����x mol������˵����ȷ����
A.��Ӧ����Ԫ�ر�������������Ԫ�ؾ�����ԭ
B.��������Fe3+������������Cu2+
C.��Ӧ��ת�Ƶ��ӵ����ʵ���Ϊx mol
D.��Ӧ���������Һ�����ֽ������ӵ������ʵ���Ϊy mol����ԭFe3+�������ʵ���Ϊ(y��x)mol
���𰸡�D
��������������Ҫ������������ԭ��Ӧ�ı��ʺ����������⡣A��CuFeS2����Ԫ�صĻ��ϼ�Ϊ+2�ۣ���Ӧ��Fe3+�Ļ��ϼ�Ϊ+3�ۣ���������Fe2+�Ļ��ϼ�Ϊ+2�ۣ����Բ���������Ԫ�ؾ�����ԭ����A����B��CuFeS2��SԪ�صĻ��ϼ�ֻ�н��ͣ�����Ԫ�صĻ��ϼ۲��䣬����CuFeS2ֻ����ԭ������ѧʽ�в��������ӣ��ǹ�������ӣ���������Fe3+����B����C�����ݷ�Ӧ��Ԫ�ػ��ϼ۵ı仯��Ԫ�ػ��ϼ۴�-1�仯Ϊ0�۱�����ΪS������������S����ԭ������Fe2+��ͭ���ӷ�Ӧǰ�ϼ۲��䣬��C����D����CuFeS2+4Fe3+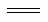 Cu2++5Fe2++2S��֪��184gCuFeS2�μӷ�Ӧת�Ƶ���Ϊ4mol����46gCuFeS2�μӷ�Ӧת�Ƶ���Ϊ1mol����D��ȷ��
Cu2++5Fe2++2S��֪��184gCuFeS2�μӷ�Ӧת�Ƶ���Ϊ4mol����46gCuFeS2�μӷ�Ӧת�Ƶ���Ϊ1mol����D��ȷ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���и����Ȼ�ѧ����ʽ�У���ѧ��Ӧ�ġ�Hǰ�ߴ��ں��ߵ��ǣ�������
��C��s��+O2��g��═CO2��g������H1 C��s��+ O2��g��═CO��g������H2
O2��g��═CO��g������H2
��S��s��+O2��g��═SO2��g������H3 S��g��+O2��g��═SO2��g������H4
��H2��g��+ O2��g��═H2O��l������H5 2H2��g��+O2��g��═2H2O��l������H6
O2��g��═H2O��l������H5 2H2��g��+O2��g��═2H2O��l������H6
��CaCO3��s��═CaO��s��+CO2��g������H7 CaO��s��+H2O��l��═Ca��OH��2��s������H8��
| �� | A�� | �� | B�� | �� | C�� | �ڢۢ� | D�� | �٢ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���и���������ָ������Һ���ܴ���������ǣ�������
����ɫ��Һ�У�K+��Cu2+��Na+��SO42﹣
�ڳ�����pH=11����Һ�У�CO32﹣��Na+��AlO2﹣��NO3﹣
�ۼ���Al�ܷų�H2����Һ�У�Cl﹣��HCO3﹣��NO3﹣��NH4+
������ˮ�������c��OH﹣��=10﹣13 mol•L﹣1����Һ�У�Na+��Ba2+��Cl﹣��I﹣
����ʹ��ɫʯ����ֽ��Ϊ��ɫ����Һ��Na+��Al3+��Cl﹣��S2﹣
��ʹpH��ֽ�ʺ�ɫ����Һ�У�Fe2+��Al3+��NO3﹣��Cl﹣��
| �� | A�� | �ڢ� | B�� | �ۢ� | C�� | �ܢ� | D�� | �ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ú��������úΪԭ�ϣ�������ѧ�ӹ�ʹúת��Ϊ���塢Һ�塢����ȼ���Լ����ֻ�����Ʒ�Ĺ�ҵ���̡�
(1)��ˮ����ͨ�����ȵ�̿���ɲ���ˮú������ӦΪ��C(s)+H2O(g)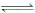 CO(g)+H2 (g) ��H = + 131.3 kJ • mol﹣1�� ��S = +133.7 J∙K﹣1•mol﹣1
CO(g)+H2 (g) ��H = + 131.3 kJ • mol﹣1�� ��S = +133.7 J∙K﹣1•mol﹣1
�ٸ÷�Ӧ�ܷ��Է�������___________�йء�
��һ���¶��£���һ���ݻ��ɱ���ܱ������У� ����������Ӧ���������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����___________(����ĸ)��
a.�����е�ѹǿ����
b.1 mol H—H�����ѵ�ͬʱ����2 mol H—O��
c.v��(CO)=v��(H2O)
d.c(CO)=c(H2)
(2)����ͬ����CO(g)��H2O(g)�ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У����з�ӦCO(g)+H2O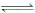 CO2(g)+H2 (g)���õ������������ݣ�
CO2(g)+H2 (g)���õ������������ݣ�
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
��ʵ��1����v(CO2)��ʾ�ķ�Ӧ����Ϊ__________��
�ڸ÷�Ӧ���淴ӦΪ__________(������š�)�ȷ�Ӧ��
����ʹʵ��3�ﵽ��ʵ��2��ͬ��ƽ��״̬(�������ʵ����������ֱ����)����t��3min�� ��a��bӦ����Ĺ�ϵ��______________(�ú�a��b����ѧʽ��ʾ)��
(3)Ŀǰ��ҵ����һ�ַ�������CO2�������״���һ�������·�����Ӧ��
CO2(g)+3H2(g)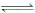 CH3OH(g)+ H2O(g)����ͼ��ʾ�÷�Ӧ���й���������(��λΪkJ • mol﹣1)�ı仯�������Ϊ1 L�ĺ����ܱ������У�����1 mol CO2��3 mol H2 �����д�ʩ����ʹc(CH3OH)�������__________��
CH3OH(g)+ H2O(g)����ͼ��ʾ�÷�Ӧ���й���������(��λΪkJ • mol﹣1)�ı仯�������Ϊ1 L�ĺ����ܱ������У�����1 mol CO2��3 mol H2 �����д�ʩ����ʹc(CH3OH)�������__________��

a.�����¶�
b.����He(g)��ʹ��ϵѹǿ����
c.��H2O(g)����ϵ�з������
d.�ٳ���1 mol CO2��3 mol H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ѧ������ѧϰ��ѧ�Ĺ��ߺͻ����������йػ�ѧ�����ʹ����ȷ����
A.ʳ�׳����Ե�ԭ���ǣ�CH3COOH��H2O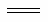 CH3COO����H3O��
CH3COO����H3O��
B.������Һ�ʼ��Ե�ԭ���ǣ�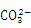 ��2H2O
��2H2O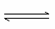 H2CO3��2OH��
H2CO3��2OH��
C.��������������ⱥ��ʳ��ˮ�����ӷ���ʽ��Fe��2H2O Fe(OH)2��H2��
Fe(OH)2��H2��
D.��ʾ����ȼ���ȵ��Ȼ�ѧ����ʽΪ��2H2(g)��O2(g)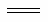 2H2O(l)��
2H2O(l)�� H����571.6kJ·mol��1
H����571.6kJ·mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��������(SF6)�������õĸ�ѹ��Ե�ԣ��ڵ�����ҵ�����Ź㷺����;��SF6���ӳ���������ṹ��S ԭ��λ��������������ġ����й���SF6���Ʋ��У���ȷ����
A.SF6��������ȼ�տ�����SO2
B.SF6������ԭ�Ӿ���
C.SF6�ǷǼ��Է���
D.SF6�и�ԭ�ӵ�������Ӳ㶼�ﵽ8�����ȶ��ṹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��0.2mol•L﹣1 HCN��Һ��0.1mol•L﹣1��NaOH��Һ�������Ϻ���Һ�Լ��ԣ����й�ϵʽ����ȷ����
��������
| �� | A�� | c��HCN����c��CN﹣�� | B�� | c��Na+������CN﹣�� |
| �� | C�� | c��HCN��﹣c��CN﹣��=c��OH﹣�� | D�� | c��HCN��+c��CN﹣��=0.1mol•L﹣1 |
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
25��ʱ���й�����ĵ��볣�����±�������˵����ȷ���ǣ�������
| ���� | CH3COOH | HCN | H2CO3 |
| Ka | 1.8��10﹣5 | 4.9��10﹣10 | K1��4.3��10﹣7 K2��5.6��10﹣11 |
| �� | A�� | ������ʵ���Ũ����ҺpH��ϵ��pH ��NaCN����pH ��Na2CO3����pH ��CH3COONa�� |
| �� | B�� | ������ʵ���Ũ�ȵ�HCN��NaCN�����Һ�У�c ��HCN��+c��H+��=c ��OH﹣��+c ��CN﹣�� |
| �� | C�� | a mol/LHCN��b mol/LNaOH��Һ�������Ϻ����õ���Һ�У���c��Na+����c ��CN﹣������aһ��С��b |
| �� | D�� | ��Na2CO3���뵽HCN��Һ��ʱ�������·�Ӧ��Na2CO3+HCN=NaCN+NaHCO3 |
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
Ϊ̽���������ȡ����Ӧ��������ͼװ�â��������ʵ�飺
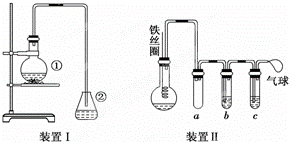
��һ�����ı����������ƿ�У�ͬʱ����������м��3��5min���ֵ���AgNO3����ƿ����dz��ɫ�ij������ɣ���֤�������巢����ȡ����Ӧ��
��1��װ��I�Т��еķ�Ӧ����ʽΪ���������ӷ���ʽΪ������
��2�����г����ܵ�������������
��3����ƿ�����ɵĺ��ɫ��״Һ�εijɷ���������Ҫ��õ������IJ�����������Լ�ϴ�ӣ�ϴ�Ӻ����ֲ�ƷӦʹ�õ�����������
��4����ͬѧ�����ͼ��ʾװ�â�������ijЩ�Լ���ɸ�ʵ�飮��ѡ�õ��Լ��ǣ�����Һ�壻Ũ�������������Һ����������Һ�����Ȼ�̼��
a��������������
b�е��Լ���������
��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com