
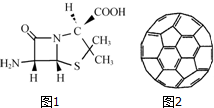
 在人类文明的历程中,许多物质发挥过重要作用,如铁、硝酸钾、青霉素、聚乙烯、二氧化硅、富勒烯、含铬物质等.
在人类文明的历程中,许多物质发挥过重要作用,如铁、硝酸钾、青霉素、聚乙烯、二氧化硅、富勒烯、含铬物质等.分析 (1)根据元素符号,判断元素原子的核外电子数,再根据构造原理来写;
(2)根据价层电子对互斥理论确定离子空间构型,根据等电子体是指具有相同价电子总数和原子总数的分子或离子来回答;
(3)根据价层电子对互斥理论判断硫原子的杂化方式,同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,据此判断第一电离能大小顺序;
(4)根据晶体构成微粒判断晶体类型;C60分子中所有均达到8电子稳定结构,则每个碳原子周围要形成4对共用电子对,根据结构图可知,每个碳周围只有3个共价键,则应为两个单键和一个双键;
(5)能和硝酸银反应生成白色沉淀的是配合物中外界氯离子,根据硝酸银的物质的量计算配合物化学式中氯离子个数,再根据配位数确定內界,从而确定其化学式.
解答 解:(1)Fe元素为26号元素,原子核外有26个电子,所以核外电子排布式为:1s22s22p63s23p63d64s2,铁原子失去最外层4s能级2个电子,然后失去3d能级上的1个电子形成Fe3+,Fe3+的电子排布式为1s22s22p63s23p63d5,所以基态Fe3+的价电子排布式为3d5;
故答案为:3d5;
(2)NO3-中N原子价层电子对=3+$\frac{1}{2}$(5+1-3×2)=3,且不含孤电子对,所以是平面三角形结构,NO3-中有4个原子,5+6×3+1=24个价电子,CO32-有4个原子,4+6×3+2=24个价电子,所以与N03-互为等电子体的另一种阴离子为CO32-,
故答案为:平面正三角形;CO32-;
(3)6氨基青霉烷酸结构中S形成2个σ键,孤对电子数为$\frac{6-2×1}{2}$=2,价层电子对个数=2+2=4,根据价层电子对互斥理论知硫原子的杂化方式为sp3,同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,C、N、O元素处于同一周期且原子序数逐渐增大,N处于第VA族,所以第一电离能N>O>C,
故答案为:sp3;N>O>C;
(4)根据富勒烯(C60)的结构可以看出每个C原子和其它三个C原子成键,则每个碳原子必形成一个双键、两个单键,即每个碳原子实际占有$\frac{1}{2}$个双键、1个单键,则C60中共有C=C键数为30个、C-C单键数为60个;C60Cl10可看作C60+5Cl2→C60Cl10(加成而得),在加成过程中,断开5个C=C键变为5个C-C键,同时形成10个C-Cl单键,此时有:C=C键数25个、C-C键数60+5=65个、C-Cl键数10个,所以1mol C60Cl10分子中含有碳碳单键的数目为65NA,
故答案为:65NA;
(5)能和硝酸银反应生成白色沉淀的是配合物中外界氯离子,n(AgNO3)=2mol•L-1×0.05L=0.1mol,0.1molCrCl3•6H2O和0.1mol硝酸银反应生成氯化银沉淀,所以该配合物外界氯离子个数是1,则有2个氯原子是配位原子,该配合物的配位数是6,所以有4个水分子是配体,则该配离子的化学式为[Cr(H2O)4Cl2]+
故答案为:[Cr(H2O)4Cl2]+.
点评 本题考查较综合,涉及电子数排布式的书写、杂化方式的判断、晶胞的计算、配合物化学式的确定等知识,都是学习重点,难点是(4)C60Cl10可看作C60+5Cl2→C60Cl10(加成而得)并利用数学方法法分析,题目难度中等.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①②③ | C. | ②④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、H+、NO3-、HCO3- | B. | K+、Na+、HCO3-、OH- | ||
| C. | Na+、Ba2+、SO32-、Cl- | D. | Na+、CH3COO-、CO32-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C6H6+C2H5Cl→C6C5-C2H5+HCl | |
| B. | C6H6+C2H5OH→C6H5-C2H5+H2O | |
| C. | C6H6+CH2=CH2→C6H5-C2H5 | |
| D. | C6H5-CH2CH2Br→C6H5-CH=CH2+HBr;C6H5-CH=CH2+H2→C6H5C2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 盐酸 | 50mL | 50mL | 50mL |
| m(混合物) | 9.2g | 14.2g | 27.6g |
| V(CO2)(标准状况) | 2.24L | 3.36L | 3.36L |
| A. | 盐酸的物质的量浓度为3.0 mol/L | |
| B. | 当混合物质量为9.2 g时,50 mL盐酸恰好完全反应 | |
| C. | 混合物中NaHCO3、KHCO3的物质的量之比为1:2 | |
| D. | 混合物中NaHCO3的质量分数为45.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验 | 操作 |
| A | 钠与水反应 | 用镊子从煤油中去除金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B | 配制一定浓度的碳酸钠溶液1000mL | 准确称取碳酸的固体,放入到1000mL的容量瓶中,加水溶解,振荡摇匀、定容 |
| C | 排除碱式滴定管尖嘴部分的气泡 | 将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 |
| D | 去除分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出至截面上,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端放出 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 电化学降解NO3-的原理如图所示,若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为a克,则a值为( )
电化学降解NO3-的原理如图所示,若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为a克,则a值为( )| A. | 14.4 | B. | 10.4 | C. | 12.4 | D. | 14.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +NaOH$→_{△}^{乙醇}$
+NaOH$→_{△}^{乙醇}$ +NaBr+H2O.
+NaBr+H2O. .
. 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸△}^{CH_{3}COOH}$CH3COOCH2CH3.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸△}^{CH_{3}COOH}$CH3COOCH2CH3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com