解答:
解:(1)图象分析反应是放热反应,反应的焓变=断裂化学键吸收的能量-形成化学键放出的热量=E
1-E
3,标注物质的聚集状态和对应反应的焓变写出热化学方程式为:CO(g)+2H
2(g)?CH
3OH(g)△H=(E
1-E
3)或-(E
3-E
1)kJ?mol
-1 ,
故答案为:CO(g)+2H
2(g)?CH
3OH(g)△H=(E
1-E
3)或-(E
3-E
1)kJ?mol
-1 ;
(2)图象分析可知是逆反应速率增大,反应是否达到平衡不知,所以增大逆反应速率的因素均符合,如加压、等倍增加反应物和生成物、增加甲醇浓度、升高温度、使用催化剂等,
故答案为:增加甲醇浓度;使用催化剂;
(3)判断反应达到平衡状态的依据正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化;
A.无论反应是否达到平衡状态,生成CH
3OH的速率与消耗CO的速率始终相等,所以不能作为判断平衡状态的依据,故A错误;
B.混合物的质量始终不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为判断平衡状态的依据,故B错误;
C.反应前后,混合气体的物质的量改变,气体的质量不变,反应达到平衡状态时,混合气体的相对平均分子质量不变,所以能作为判断平衡状态的依据,故C正确;
D.反应达到平衡状态时,CH
3OH、CO、H
2的浓度都不再发生变化,所以能作为判断平衡状态的依据,故D正确;
E.容器内CO、H
2、CH
3OH的浓度之比为1:2:1,和起始量,变化量有关,不能作为平衡的标志,故E错误;
故选CD;
(4)在一定温度下,若将4a mol H
2和2a mol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,依据平衡三段式列式计算;
CO(g)+2H
2(g)?CH
3OH(g)
起始量(mol/L) a 2a 0
变化量(mol/L)50%×a a 0.5a
平衡量(mol/L)0.5a a 0.5a
则该反应的平衡常数K=
=
;
若此时再向该容器中投入a mol CO、2a mol H
2和a mol CH
3OH,浓度为c(CO)=
mol/L+0.5amol/L=amol/L,c(H
2)=
+amol/L=2a,c(CH
3OH)=
mol/L+0.5amol/L=amol/L,Q=
=
<K=
,判断平衡移动的方向是反应正向进行;达到新平衡与原平衡相比,CO的物质的量浓度增大;
故答案为:
;正向移动;增大;
(4)燃料电池中,正极反应一定是氧气得电子,该电池的电解质环境是熔融碳酸盐,所以电极反应为:O
2+2CO
2+4e
-=2CO
32-,负极是燃料失电子生成二氧化碳,负极电极反应为:CH
4+4CO
32--8e
-=5CO
2+2H
2O;
故答案为:CO
2;CH
4+4CO
32--8e
-=5CO
2+2H
2O.

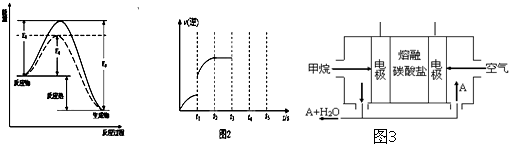


 (1)某可逆反应在不同条件下的反应历程分别为A、B,如图所示.
(1)某可逆反应在不同条件下的反应历程分别为A、B,如图所示. 据报道,一定条件下由二氧化碳和氢气合成乙醇已成为现实.
据报道,一定条件下由二氧化碳和氢气合成乙醇已成为现实.