


分析 (1)根据质合比可知,该有机物A的相对分子量为46;
(2)根据2.3g该有机物充分燃烧生成的二氧化碳、水的量判断有机物A中的碳元素、氢元素的物质的量、质量,再判断是否含有氧元素,计算出C、H、O元素的物质的量之比,最后确定A的实验式;
(3)结合核磁共振氢谱判断该有机物分子的结构简式,羟基中氧原子与氢原子共用1对电子,氧原子核外有7个电子;
(4)由A的一种同系物B分子中比A多4个s-sp3 H-C σ键,则B中有9个s-sp3 H-C σ键,又核磁共振氢谱图只有二个吸收峰,说明9个s-sp3 H-C σ键一模一样,据此分析.
解答 解:(1)在A的质谱图中,最大质荷比为46,所以其相对分子质量也是46,故答案为:46;
(2)2.3 g该有机物中,n(C)=n(CO2)=0.1 mol,含有的碳原子的质量为m(C)=0.1 mol×12 g•mol-1=1.2 g,
氢原子的物质的量为:n(H)=$\frac{2.7g}{18g/mol}$×2=0.3 mol,氢原子的质量为m(H)=0.3 mol×1 g•mol-1=0.3 g,
该有机物中m(O)=2.3 g-1.2 g-0.3 g=0.8 g,氧元素的物质的量为n(O)=$\frac{0.8g}{16g/mol}$=0.05 mol,
则n(C):n(H):n(O)=0.1 mol:0.3 mol:0.05 mol=2:6:1,所以A的实验式是:C2H6O,
故答案为:C2H6O;
(3)A有如下两种可能的结构:CH3OCH3或CH3CH2OH;若为前者,则在核磁共振氢谱中应只有1个峰;若为后者,则在核磁共振氢谱中应有3个峰,而且3个峰的面积之比是1:2:3,显然CH3CH2OH符合题意,所以A为乙醇,结构式为CH3CH2OH,官能团为羟基,电子式为: ,故答案为:CH3CH2OH;
,故答案为:CH3CH2OH; ;
;
(4)由A的一种同系物B分子中比A多4个s-sp3 H-C σ键,则B中有9个s-sp3 H-C σ键,又核磁共振氢谱图只有二个吸收峰,说明9个s-sp3 H-C σ键一模一样,所以B的结构非常对称,则结构简式为(CH3)3COH,故答案为:(CH3)3COH.
点评 本题考查了有机物实验式、结构简式的计算方法以及结构的推断等,题目难度中等,注意根据质量守恒确定有机物实验式的方法,明确质量比、核磁共振氢谱的含义是解题关键.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫酸铁溶液中滴加硫氰化钾溶液 | B. | 氯化铝中滴加石蕊指示剂 | ||
| C. | 偏铝酸钠溶液中滴加酚酞指示剂 | D. | 氯化亚铁溶液中滴加硫氰化钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )| A. | 电池总反应为H2+2NiOOH$?_{放电}^{充电}$2Ni(OH)2 | |
| B. | 放电时,甲电极为负极,OH-移向乙电极 | |
| C. | 放电时,乙电极反应为:NiO(OH)+H2O+e-═Ni(OH)2+OH- | |
| D. | 充电时,电池的碳电极与直流电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石英是制造光导纤维的原料,也是常用的半导体材料 | |
| B. | 氧化铝是冶炼金属铝的原料,也是较好的耐火材料 | |
| C. | 天然氨基酸能溶于强碱或强酸溶液,是两性化合物 | |
| D. | 船舶外壳装上锌块,是牺牲阳极的阴极保护法进行防腐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷在空气中完全燃烧 | |
| B. | 在镍做催化剂的条件下,苯与氢气反应 | |
| C. | 乙烯通入溴水中 | |
| D. | 乙醇与乙酸制备乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,有机物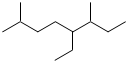 可命名为3,7-二甲基-4-乙基辛烷 可命名为3,7-二甲基-4-乙基辛烷 | |
| B. | 环己醇分子中所有的原子可能共平面 | |
| C. | 麻黄碱(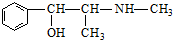 )的催化氧化产物能发生银镜反应 )的催化氧化产物能发生银镜反应 | |
| D. | 某分子式为C10H20O2的酯可发生如图所示的转化过程,则符合条件的酯的结构有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(NO3)2溶液$\stackrel{通入SO_{2}}{→}$白色沉淀 | |
| B. | 无色溶液$\stackrel{稀HNO_{3}}{→}$ $\stackrel{BaCl_{2}溶液}{→}$白色沉淀 | |
| C. | Ba(NO3)2溶液$\stackrel{加过量HCl}{→}$无现象 $\stackrel{Na_{2}SO_{4}}{→}$白色沉淀 | |
| D. | Fe(NO3)2溶液$\stackrel{加过量HCl}{→}$ $\stackrel{通入SO_{2}}{→}$ $\stackrel{BaCl_{2}}{→}$白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol液态水完全分解成氢气与氧气,需吸收571.6KJ热量 | |
| B. | 2mol氢气与1mol氧气的总能量大于2mol 液态水的总能量 | |
| C. | 2 g 氢气与16 g氧气完全反应生成18g液态水放出285.8 KJ热量 | |
| D. | 2mol氢气与1mol氧气完全反应生成水蒸汽放出的热量大于571.6KJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com