
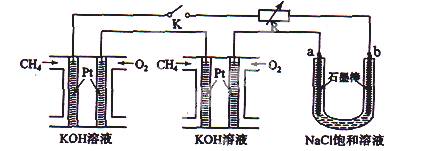
(10��)����Ч�ļ���ȼ�ϵ�ز��ò�Ϊ�缫���ϣ����缫�Ϸֱ�ͨ��CH4��O2 �������ΪKOH��Һ��ij�о�С�齫��������ȼ�ϵ�ش�������Ϊ��Դ�����б����Ȼ�����Һ���ʵ�飬��ͼ��ʾ��
�ش��������⣺
(1)����ȼ�ϵ�������������ĵ缫��Ӧ�ֱ�Ϊ �� ��
(2)�պ�K���غ�a��b�缫�Ͼ����������������b�缫�ϵõ����� ������Ȼ�����Һ���ܷ�Ӧ����ʽΪ ��
(3)��ÿ����ؼ���ͨ����Ϊ1 L(��״��)���ҷ�Ӧ��ȫ��������������ܲ������������Ϊ L(��״��)��
��1��2O2+4H2O +8e��=8OH�� CH4+10OH--8e��=CO32-+ 7H2O
��2��H2 2NaCl+2H2O 2NaOH+ H2��+ Cl2�� ��3��4
2NaOH+ H2��+ Cl2�� ��3��4
���������������1��ԭ����и���ʧȥ���ӣ������õ����ӣ����Լ����ڸ���ͨ�룬����������ͨ�룬����ʽΪCH4��10OH����8e��= CO32����7H2O��2O2 + 4H2O +8e��= 8OH����
��2���պ�K���غ�b�缫�͵�Դ�ĸ�������������������Һ�е������ӷŵ磬��������������Ȼ�����Һ�ķ���ʽΪ2NaCl��2H2O  2NaOH��H2����Cl2����
2NaOH��H2����Cl2����
��3��һ��������Ӳμӷ�Ӧʧȥ8�����ӣ�һ�������������ɵõ�2�����ӡ����ݵ��ӵ�ʧ�غ��֪��1L����ͨ����������4L��
���㣺ȼ�ϵ�غ͵���
��������ԭ����нϻ��õĽ�����������ʧȥ���ӣ�����������Ӧ�����Ӿ����ߴ��ݵ������ϣ�������Һ�е��������������ƶ������������ƶ��������õ����ӣ�������ԭ��Ӧ���ݴ˿��Խ����йص��жϡ�


 ��У���˿��ֿ���ϵ�д�
��У���˿��ֿ���ϵ�д� �ƸԴ��ž�ϵ�д�
�ƸԴ��ž�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| ���� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 1mol CH3OCH3��1mol H2O | 2mol CH3OH | 1mol CH3OH |
| CH3OH��Ũ�ȣ�mol/L�� | c1 | c2 | c3 |
| ��Ӧ�������仯 | ����a kJ | �ų�b kJ | �ų�c kJ |
| ƽ��ʱ�����L�� | V1 | V2 | V3 |
| ��Ӧ��ת���� | �� 1 | �� 2 | �� 3 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
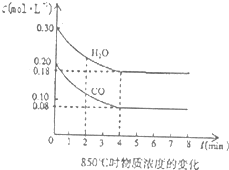 �����ѣ�CH3OCH3����һ�ָ�Ч����࣬���������������ܵ�����ȼ�ϣ���ҵ���Ʊ�������ʱ�ڴ���Ӧ���У�ѹǿ2.0��10.0MPa���¶�230��280�棩���еķ�ӦΪ��
�����ѣ�CH3OCH3����һ�ָ�Ч����࣬���������������ܵ�����ȼ�ϣ���ҵ���Ʊ�������ʱ�ڴ���Ӧ���У�ѹǿ2.0��10.0MPa���¶�230��280�棩���еķ�ӦΪ��| 0.3��mol/L��0��3mol/L |
| 0.4mol/L��0.2mol/L |
| 9 |
| 8 |
| 0.12mol/L��0.12mol/L |
| 0.08mol/L��0.18mol/L |
| 0.3��mol/L��0��3mol/L |
| 0.4mol/L��0.2mol/L |
| 9 |
| 8 |
| 0.12mol/L��0.12mol/L |
| 0.08mol/L��0.18mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����������⣺?
��1������������ˮ������ԭ����________������������������ˮ��pHӰ�죬pHСʱ����������________pH��ʱ���������������������)����ԭ����________________________��?
��2��ͨ���������ƣ�NaClO3����Ũ���ᷴӦ����ȡClO2��ͬʱ����Cl2��д����ѧ����ʽ��________________�����۵�һ�����������������ֳɷ֣��ֱ���NaClO3��Na
ijͬѧ����ͨ���о���ѧϰ���Ƚ���������ȡClO2�ķ���������ס�Ҫ�ⶨһ�����Ե��о�����������ΪӦ�ô���Щ��������о���
__________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ���㽭ʡ�����и�����ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ������
(10��)����Ч�ļ���ȼ�ϵ�ز��ò�Ϊ�缫���ϣ����缫�Ϸֱ�ͨ��CH4��O2 �������ΪKOH��Һ��ij�о�С�齫��������ȼ�ϵ�ش�������Ϊ��Դ�����б����Ȼ�����Һ���ʵ�飬��ͼ��ʾ��
�ش��������⣺
(1)����ȼ�ϵ�������������ĵ缫��Ӧ�ֱ�Ϊ �� ��
(2)�պ�K���غ�a��b�缫�Ͼ����������������b�缫�ϵõ����� ������Ȼ�����Һ���ܷ�Ӧ����ʽΪ ��
(3)��ÿ����ؼ���ͨ����Ϊ1 L(��״��)���ҷ�Ӧ��ȫ��������������ܲ������������Ϊ L(��״��)��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com