
在一定温度下,向饱和烧碱溶液中加入一定量的过氧化钠,充分反应后恢复到原温度,下列说法正确的是()
A. 溶液中有晶体析出,Na+数目不变
B. 溶液中有气体逸出,Na+数目增加
C. 溶质的质量分数增大
D. 溶液中Na+数目减少,溶质质量分数未变
考点: 钠的重要化合物;溶解度、饱和溶液的概念.
分析: 过氧化钠和水反应生成氢氧化钠和氢气,消耗水,饱和的烧碱溶液中有NaOH析出,有氧气放出,得到的溶液仍然是饱和氢氧化钠溶液,据此回答判断.
解答: 解:过氧化钠和水发生:2Na+2H2O=2NaOH+H2↑,消耗水,饱和的烧碱溶液中有NaOH析出,溶液中Na+数目减少,但反应后仍为饱和溶液,溶液的pH不变,溶液中c(Na+)不变.
A、有晶体析出,Na+数目减少,故A错误;
B、有氧气放出,Na+数目减少,故B错误;
C、Na+数目减少,但反应后仍为饱和溶液,溶液的pH不变,溶质的质量分数不变,故C错误;
D、消耗水,饱和的烧碱溶液中有NaOH析出,溶液中Na+数目减少,但反应后仍为饱和溶液,溶质质量分数未变,故D正确;
故选D.
点评: 本题考查过氧化钠的性质,注意饱和溶液的性质,溶剂减小,溶液中要析出晶体,但溶液的浓度不变,为易错点.


科目:高中化学 来源: 题型:
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体 g.
(2)从图中选择称量NaOH固体所需要的仪器是(填字母): .
名称 托盘天平(带砝码) 小烧杯 坩埚钳 玻璃棒 药匙 量筒
仪器 


序号 a b c d e f
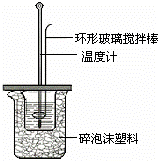
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol): .
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
温度
实验次数 起始温度t1/℃ 终止温度
t2/℃ 温度差平均值
(t2﹣t1)/℃
H2SO4 NaOH 平均值
1 26.2 26.0 26.1 30.1 4.0
2 27.0 27.4 27.2 33.3
3 25.9 25.9 25.9 29.8
4 26.4 26.2 26.3 30.4
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H= (取小数点后一位).
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母) .
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于反应热的说法正确的是()
A. 当△H<0时,表示该反应为吸热反应
B. 已知C(s)+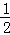 O2(g)=CO(g)△H=﹣110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol
O2(g)=CO(g)△H=﹣110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol
C. 反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D. 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
查看答案和解析>>
科目:高中化学 来源: 题型:
天然水里一般含有Ca2+、Mg2+等多种离子。人们把含有较多量Ca2+、Mg2+的水叫做硬水,含有较少量或不含Ca2+、Mg2+的水叫做软水;降低水中
Ca2+、Mg2+含量的过程叫做硬水软化。如果硬度太高(含Ca2+、Mg2+的浓度太大)会给生产、生活带来很多不利,因此硬水的软化是水处理的重要方面之一。
离子交换法常用于工业锅炉用水的软化。离子交换剂多种多样,磺化煤(NaR)
就是一种阳离子交换剂。
(1)写出用磺化煤软化含Ca2+、Mg2+浓度较高的硬水的离子方程式________
__________________________________________________________________
_________________________________________________________________。
(2)用药剂软化法软化过的水总是含有一定浓度的Ca2+、Mg2+,其原因是
__________________________________________________________________
_________________________________________________________________。
(3)烧水后的锅炉或水壶中结有水垢,据此说明如果用硬度太高的水作锅炉用
水,主要的不利因素是_______________________________________________
_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
非金属溴与氯气的性质很相似.在探究溴单质的性质时,其基本程序应该是()
A. 做实验并观察实验现象→分析、解释,得出结论
B. 观察溴的外观性质→做实验并观察实验现象→分析、 解释,得出结论
解释,得出结论
C. 观察溴的外观性质→预测溴的化学性质→做实验并观察实验现象→分析、解释,得出结论
D. 预测溴的性质→做实验并观察实验现象→分析、解释,得出结论 →观察溴的外观性质
→观察溴的外观性质
查看答案和解析>>
科目:高中化学 来源: 题型:
现有CO、CO2、O3(臭氧)三种气体,它们分别都含有1mol氧原子,则三种气体的物质的量之比为()
A. 1:1:1 B. 1:2:3 C. 3:2:1 D. 6:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
当物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液中所含Cl﹣的个数相等时,这三种溶液的体积比应是()
A. 1:1:1 B. 1:2:3 C. 3:2:1 D. 6:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列描述正确的是()
A. 氯气、活性炭都能使品红溶液褪色,它们的漂白原理相同
B. 滴加石蕊试液显红色的溶液:Fe3+、NH4+、I﹣可能大量共存
C. 某溶液中加入盐酸酸化的氯化钡产生白色沉淀,原溶液中一定含有SO42﹣
D. Fe(N03)2溶液中滴加少量稀硫酸会变黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. HClO中氯元素化合价比HClO4中氯元素化合价低,所以HClO4的氧化性强
B. 已知①Fe+Cu2+═Fe2++Cu;②2Fe3++Cu═2Fe2++Cu2+,则氧化性强弱顺序为:Fe3+>Cu2+>Fe2+
C. 已知还原性:B﹣>C﹣>D﹣,反应 2C﹣+D2═2D﹣+C2和反应2C﹣+B2═2B﹣+C2都能发生
D. 具有强氧化性和强还原性的物质放在一起就能发生氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com