
 铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:| 温度 | 250℃ | 600℃ | 1000℃ | 2000℃ |
| 主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| x(CO) | 0.25 | 0.23 | 0.214 | 0.202 | 0.193 | 0.193 |
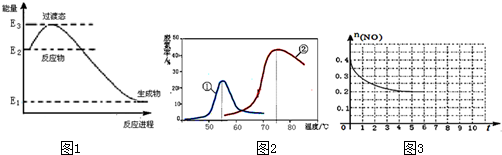
分析 (1)根据盖斯定律,将所给的反应②+③×$\frac{2}{3}$可得:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),反应热做相应的变化即可;
(2)根据当1000℃时为FeO,在2000℃时为Fe来分析;设混合物中FeO的物质的量为xmol,Fe的物质的量为ymol,则有:$\frac{x+y}{x}$=$\frac{\frac{35}{56}}{\frac{2}{16}}$,即可求的x:y;
(3)①当一个量,在反应达平衡之前在变化,而后来不变了,则能说明反应达平衡;
②设反应达平衡时CO转化了xmol,根据三段式结合平衡时CO的体积分数来计算;在T℃106Pa时该反应的压强平衡常数Kp$\frac{p(C{H}_{4})•p({H}_{2}O)}{p(CO)•{p}^{3}({H}_{2})}$来计算;
③反应CO(g)+3H2(g)?CH4(g)+H2O(g)△H<0,温度越高,则平衡左移,CO的平衡转化率越低.
解答 解:(1)已知反应:Fe2O3(s)+$\frac{1}{3}$CO(g)═$\frac{2}{3}$Fe3O4(s)+$\frac{1}{3}$CO2(g)△H2 ②
Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H3 ③
,根据盖斯定律,将所给的反应②+③×$\frac{2}{3}$可得:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),故△H4=△H2+$\frac{2}{3}$△H3 ,故答案为:△H2+$\frac{2}{3}$△H3 ;
(2)根据当1000℃时为FeO,在2000℃时为Fe,故在1600℃时固体物质的主要成分为FeO和Fe的混合物;设混合物中FeO的物质的量为xmol,Fe的物质的量为ymol,则有:$\frac{x+y}{x}$=$\frac{\frac{35}{56}}{\frac{2}{16}}$,即可求的x:y=1:4,故剩余的FeO和被还原为铁的FeO的物质的量之比为1:4,则可知被还原的FeO的百分比为$\frac{4}{1+4}$×100%=80%,故答案为:FeO和Fe;80%;
(3)①a.由于此容器是个体积可变的容器,故为恒容的容器,则容器内压强一直不变,故不能作为反应达平衡的标志,故a错误;
b.此反应在平衡前,气体的质量不变,但体积变小,故密度变大,故当混合气体的密度不再发生变化时能说明反应达平衡,故b正确;
c.反应达平衡的根本标志是v正=v逆,所以3v正(CO)=v逆(H2),故c错误;
d.在反应达平衡之前,混合气体的质量不变,但物质的量变小,故混合气体的平均相对分子质量在变小,故当不变时能说明反应达平衡,故d正确.
故选bd;
②设反应达平衡时CO转化了xmol,则根据三段式可知:
CO(g)+3H2(g)?CH4(g)+H2O(g)
初始(n):1mol 3mol 0 0
△n:xmol 3xmol xmol xmol
平衡(n):(1-x)mol(3-3x)mol xmol xmol
结合平衡时CO的体积分数为0.193可知:$\frac{1-x}{4-2x}$=0.193,解得x=0.371,故达到平衡时CO的转化率为=$\frac{0.371mol}{1mol}×100%=37.1%$;
在T℃106Pa时该反应的压强平衡常数Kp$\frac{p(C{H}_{4})•p({H}_{2}O)}{p(CO)•{p}^{3}({H}_{2})}$=$\frac{(\frac{0.371}{3.258})^{2}}{0.193×(\frac{1.887}{3.258})^{3}×1{0}^{12}P{a}^{2}}$,故答案为:37.1%;$\frac{(\frac{0.371}{3.258})^{2}}{0.193×(\frac{1.887}{3.258})^{3}×1{0}^{12}P{a}^{2}}$;
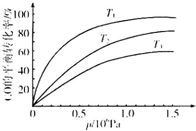
③反应CO(g)+3H2(g)?CH4(g)+H2O(g)△H<0,温度越高,则平衡左移,CO的平衡转化率越低,根据图象可知,温度T3>T2>T1,
故答案为:T3>T2>T1;正反应放热,在相同压强下,温度降低,平衡向正反应方向移动,CO的转化率越高.
点评 本题综合考查了盖斯定律的应用、平衡常数的求算和图象的应用,综合性较强,一直是高考的常见题型,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 该溶液中:c(OH-)>c(Na+)>c(CO32-)>c(HCO3-)>c(H+) | |
| B. | 该溶液中:c(Na+)+c(H+)═c(OH-)+2c(CO32-)+c(HCO3-) | |
| C. | 加水稀释该溶液,恢复至原温度,pH增大,Kw不变 | |
| D. | 该溶液pH约为13的原因:CO32-+H2O═HCO3-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
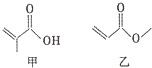
| A. | 甲、乙互为同分异构体 | |
| B. | 甲、乙都能与溴的单质发生加成反应 | |
| C. | 一定条件下,甲、乙均能发生取代反应 | |
| D. | 甲、乙都能与金属钠反应生成氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,1molN2和3molH2充分反应,生成物中的N-H键数目为6NA | |
| B. | 9.2g 由NO2和N2O4组成的混合物中含有氧原子的数目为 0.2NA | |
| C. | 完全燃烧1.5molCH3CH2OH和C2H4的混合物,转移电子数为18NA | |
| D. | 1L 0.1 mol•L-l的Na2S溶液中S2-和HS-的总数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
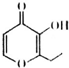 俗称“一滴香”的物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
俗称“一滴香”的物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )| A. | 该有机物的分子式为C8H8O3 | |
| B. | 1 mo1该有机物最多能与 2 mol H2发生加成反应 | |
| C. | 该有机物能发生取代、加成和氧化反应 | |
| D. | 该有机物能与碳酸氢钠反应生成CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
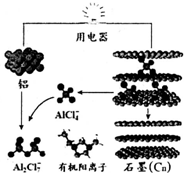 2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,分别以金属铝和石墨为电极,用AlCl4-、A12C17-和有机阳离子组成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,分别以金属铝和石墨为电极,用AlCl4-、A12C17-和有机阳离子组成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 放电时,铝为负极、石墨为正极 | |
| B. | 充电时的阳极反应为:Cn+AlCl4--e-=Cn AlCl4 | |
| C. | 放电时的负极反应为:Al-3e-+7 AlCl4-═4A12C17- | |
| D. | 放电时,有机阳离子向铝电极方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中存在两个平衡、七种粒子 | |
| B. | 该溶液中K+、NH4+、NO3-、Al3+可以大量共存 | |
| C. | 滴加少量稀硫酸,充分振荡无现象 | |
| D. | 通入足量SO2气体,发生反应的离子方程式:2S2-+SO2+2H2O═3S↓+4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
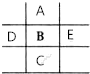 如图是元素周期表的一部分,已知A、B、C、D、E5种原子核外共有85个电子,其中只有C元素原子次外层电子数为18,则B元素是( )
如图是元素周期表的一部分,已知A、B、C、D、E5种原子核外共有85个电子,其中只有C元素原子次外层电子数为18,则B元素是( )| A. | 铝 | B. | 镁 | C. | 磷 | D. | 硫 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com