
| 验方法 | 沉淀法 | 显色法 | 气体法 |
| 判断的依据 | 反应中有沉淀产生或溶解 | 反应中有颜色变化 | 反应中有气体产生 |
| A. | CO32---气体法 | B. | SO42---沉淀法 | C. | H+--显色法 | D. | Cl---气体法 |
分析 A、碳酸根离子一般和酸反应产生使石灰水变浑浊的二氧化碳;
B、SO42-检验是生成了硫酸钡沉淀;
C、氢离子用PH试纸或者酸碱指示剂检验;
D、Cl-检验是生成了氯化银沉淀.
解答 解:A、碳酸根离子会和酸反应产生石灰水变浑浊的气体,采用的是气体法,故A正确;
B、SO42-检验是加稀盐酸和氯化钡溶液,生成了硫酸钡沉淀,所以是沉淀法,故B正确;
C、氢离子利用的PH试纸或者酸碱指示剂显色,故是显色法,故C正确;
D、检验Cl-利用的是生成氯化银沉淀,故是沉淀法,故D错误;
故选D.
点评 本题考查离子的检验,注重信息的分析、理解能力,难度中等,注意把握常见离子的检验方法,侧重于基础知识的考查..


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | 混合液中c(SO${\;}_{4}^{2-}$)为0.04 mol•L-1 | |
| B. | 原Al2(SO4)3溶液中c(Al3+)与100 mL 0.02 mol•L-1 Al(NO3)3中c(Al3+)相等 | |
| C. | 混合后的溶液中含有0.003 mol Na+ | |
| D. | 混合后溶液中c(Na+)为0.02 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下列说法错误的是( )
下列说法错误的是( )| A. | 对甲苯丙烯酸的分子式为C10H10O2 | |
| B. | 对甲苯丙烯酸能发生的反应类型有加成、取代、氧化 | |
| C. | 对甲苯丙烯酸中所有碳原子有可能共平面 | |
| D. | 对甲苯丙烯酸能使酸性高锰酸钾溶液和溴水褪色,其原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | CuSO4溶液中加入Ba(OH)2溶液:Ba2++SO42-═BaSO4↓ | |
| C. | 将鸡蛋壳在醋酸中溶解有气泡产生:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 硫酸铜溶液与铁粉反应:Cu2++Fe═Fe2++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


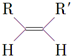 $\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO
$\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO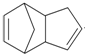 $\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$
$\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$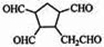 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过滤的方法分离CaCO3和CaCl2溶液的混合物 | |
| B. | 用结晶法提纯NaCl和KNO3混合物中的KNO3 | |
| C. | 用蒸馏法分离乙醇和水的混合物 | |
| D. | 用加热法分离碘和氯化铵的混合物(提示:碘易升华,氯化铵受热易分解.冷却后它们都又重新生成固体) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
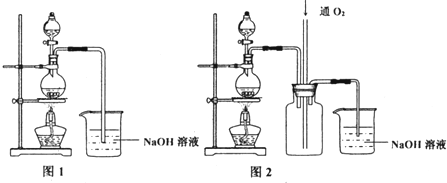
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com