
【题目】如图为25℃时,向25mL0.1mol·L-1NaOH溶液中逐滴滴加0.2mol·L-1CH3COOH溶液过程中混合溶液pH的变化曲线。
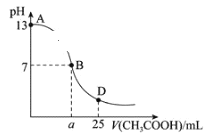
(1)NaOH与CH3COOH恰好完全反应时溶液中各离子浓度大小关系为__。
(2)AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是__(填序号)。
A.c(OH-)一定大于c(CH3COO-) B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-) D.c(OH-)大于、小于或等于c(CH3COO-)
(3)在B点时,溶液中各离子浓度大小关系为__。
(4)在D点时,溶液中c(CH3COO-)+c(CH3COOH)__2c(Na+)(填“>”“<”或“=”)。D点混合溶液的质子守恒的关系为__。
【答案】c(Na+)>c(CH3COO-)>c(OH-)>c(H+) D c(Na+)=c(CH3COO-)>c(H+)=c(OH-) = c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
【解析】
以滴定实验为背景,结合滴定曲线进行分析,后面的小题又对离子浓度大小进行比较,最后涉及了离子积常数的计算以及pH值的计算。
(1)醋酸钠水解使溶液显碱性,NaOH与CH3COOH恰好完全反应时,离子浓度大小关系:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
(2)A.在AB段溶液显示碱性,在接近B点时,溶液中醋酸根离子浓度远远大于氢氧根离子浓度,选项A错误;
B.在接近A时,即加入的醋酸少量,则混合液中氢氧根离子浓度大于醋酸根离子,选项B错误;
C.在AB段,根据选项A、B的分析可知,混合液中氢氧根离子浓度与醋酸根离子不一定相等,选项C错误;
D.根据以上分析可知,溶液中c(OH-)可能大于、等于或小于c(CH3COO-),选项D正确;
答案选D;
(3)在B点时,溶液呈中性c(H+)=c(OH-),根据电荷守恒c(Na+)+ c(H+)=c(CH3COO-)+c(OH-),则c(Na+)=c(CH3COO-),溶液中醋酸根离子浓度远远大于氢氧根离子浓度,各离子浓度大小关系为c(Na+)=c(CH3COO-)>c(H+)=c(OH-);
(4)在D点时,反应后醋酸剩余,溶液的组成为等浓度的醋酸和醋酸钠的混合物,根据物料守恒,此时:c(CH3COO-)+c(CH3COOH)=2c(Na+);D点的电荷守恒为c(Na+)+ c(H+)=c(CH3COO-)+c(OH-),将电荷守恒乘以2,由物料守恒代入消去c(Na+),则D点混合溶液的质子守恒的关系为c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)。


科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.铜跟硝酸银溶液反应:Cu+Ag+=Cu2++Ag
B.硫酸与氢氧化钡溶液反应:H++![]() +Ba2++OH-=BaSO4↓+H2O
+Ba2++OH-=BaSO4↓+H2O
C.碳酸铵与盐酸反应:![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
D.Cu(OH)2与H2SO4溶液反应:H++OH-=H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.用醋酸溶液除去水垢中的![]() :
:![]()
B.碘水中通入足量的![]() 气体:
气体:![]()
C.![]() 溶液与
溶液与![]() 溶液反应至中性:
溶液反应至中性:![]()
D.在强碱溶液中次氯酸钠与![]() 反应生成
反应生成![]() :
:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.100 0 mol·L-1NaOH溶液滴定20.00 mL 0.100 0mol·L-1CH3COOH溶液所得滴定曲线如下图。下列说法正确的是

A. 点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B. 溶液中②、③点水的电离程度:③>②
C. 点②所示溶液中:c(Na+)=c(CH3COO-)=c(H+)=c(OH-)
D. 该滴定过程应该选择甲基橙作为指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(![]() )。下列说法不正确的是
)。下列说法不正确的是
①![]()
![]()
②![]()
![]()
③![]()
![]()
④![]()
![]()
A. 反应①、②为反应③提供原料气
B. 反应③也是![]() 资源化利用的方法之一
资源化利用的方法之一
C. 反应![]() 的
的![]()
D. 反应![]() 的
的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述与图象对应符合的是( )

A. 对于达到平衡状态的N2(g)+3H2(g)![]() 2NH3(g)在t0时刻充入了一定的NH3,平衡逆向移动
2NH3(g)在t0时刻充入了一定的NH3,平衡逆向移动
B. P2>P1,T1>T2
C. 该图象表示的方程式为:2A===B+3C
D. 对于反应2X(g)+3Y(g)![]() 2Z(g) ΔH<0,y可以表示Y的百分含量
2Z(g) ΔH<0,y可以表示Y的百分含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示表示一些元素原子半径规律性的变化示意图。由此图不能得出下列结论的是(不考虑稀有气体元素)

A.当电子层数相同时,核电荷数越小,原子半径越大
B.当最外层电子数相同时,质子数越多,原子半径越大
C.r(F-)<r(Cl-)<r(Br-)<r(I-),r(K+)>r(Na+)>r(Mg2+)>r(Al3+)
D.原子电子层数越多,对应的原子半径越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家提出如下光分解法制备氢气:
①2Ce4+(aq)+H2O(l)===2Ce3+(aq)+![]() O2(g)+2H+(aq) ΔH1
O2(g)+2H+(aq) ΔH1
②Ce3+(aq)+H2O(l)===Ce4+(aq)+![]() H2(g)+OH-(aq) ΔH2
H2(g)+OH-(aq) ΔH2
③H2O(l)===H+(aq)+OH-(aq) ΔH3
④2H2O(l)===2H2(g)+O2(g) ΔH4
下列说法正确的是( )
A. Ce4+能够增大水分解反应的活化能,提高反应速率
B. Ce3+是反应②和反应③的催化剂
C. 上述反应中,ΔH4=2ΔH1+4ΔH2-4ΔH3
D. 通常条件下,反应④中生成H2、O2的速率之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物阿司匹林可由水杨酸制得,它们的结构如图所示。有关说法正确的是( )

A. 1 mol阿司匹林最多可消耗3 molH2
B. 水杨酸分子中所有原子不可能共面
C. 水杨酸可以发生取代、加成、氧化、加聚反应
D. 1 mol阿司匹林最多可消耗2 molNaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com