
| A. | 乙醇 | B. | 苯酚 | C. | 乙酸 | D. | 乙醛 |
分析 含-OH的物质与Na反应,含酚-OH、-COOH、-COOC-的物质与NaOH反应,含-COOH和酚-OH的物质与碳酸钠反应,含-COOH的物质与碳酸氢钠反应,以此来解答.
解答 解:A.乙醇不能与NaOH、NaHCO3、Na2CO3反应,故A不选;
B.苯酚不能与碳酸氢钠反应,故B不选;
C.乙酸能够与钠反应生成氢气,与氢氧化钠反应生成乙酸钠和水,与碳酸钠、碳酸氢钠反应生成醋酸钠和二氧化碳,故C选;
D.乙醛与Na、NaOH、NaHCO3、Na2CO3都不反应,故D不选;
故选:C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重常见有机物性质及分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
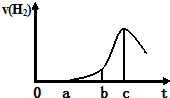 某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,下图为反应产生氢气速率与反应时间的关系图.
某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,下图为反应产生氢气速率与反应时间的关系图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 10%H2O2的体积/mL | 5.0 | 5.0 | v1 | v2 |
| 20%硫酸的体积/mL | 0 | 0.5 | 1.0 | v3 |
| 水的体积/mL | 15 | 14.5 | v4 | 13.5 |
| 所需时间/min | t1 | t2 | t3 | t4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
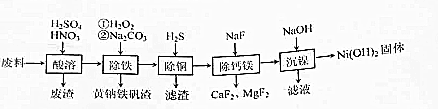
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .①②⑤ | B. | .①③④ | C. | .③④ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
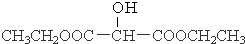 .
.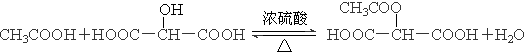 .
.
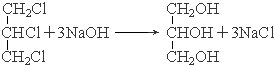 .
.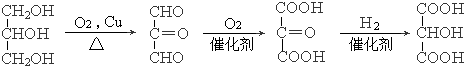 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
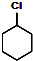 $→_{②}^{NaOH,乙醇,△}$
$→_{②}^{NaOH,乙醇,△}$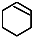 $→_{③}^{Br_{2}的CCl_{4}溶液}$B$\stackrel{④}{→}$
$→_{③}^{Br_{2}的CCl_{4}溶液}$B$\stackrel{④}{→}$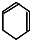
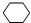 ,B的结构简式是
,B的结构简式是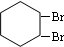 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
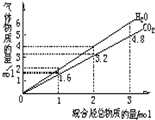 两种气态烃组成的混合气体完全燃烧后所得CO2和H2O的物质的量随混合烃总物质的量变化如图所示,则下列对混合烃的判断正确的是( )
两种气态烃组成的混合气体完全燃烧后所得CO2和H2O的物质的量随混合烃总物质的量变化如图所示,则下列对混合烃的判断正确的是( )| A. | 一定含有甲烷 | B. | 一定含有乙烯 | C. | 一定含有丙炔 | D. | 一定不含乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.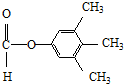 、
、 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com