
| A、方程式中x=4 | ||
| B、达到平衡时,A、B两反应物的转化率之比为α (A):α (B)=3:1 | ||
| C、若继续向原平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,正、逆反应的化学反应速率变小 | ||
D、在t℃时,若向原平衡混合物的容器中再充入amolC,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则应再充入
|
| 0.6mol |
| 3mol |
| 0.2mol |
| 2mol |
| 3 |
| 4 |
| 1 |
| 4 |
| 3 |
| 4 |
| 1 |
| 4 |
| 1 |
| 4 |


科目:高中化学 来源: 题型:
| A、化合反应均为氧化还原反应 |
| B、金属氧化物均为碱性氧化物 |
| C、蔗糖、液氨、干冰均为非电解质 |
| D、铝热剂是混合物,漂白粉为纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 所需要的仪器 | 所加的试剂名称 |
查看答案和解析>>
科目:高中化学 来源: 题型:
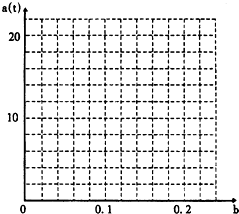 某化工厂以硫磺为原料生产硫酸.设空气中的氧气的体积分数为
某化工厂以硫磺为原料生产硫酸.设空气中的氧气的体积分数为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O2分子结构式:H-O-O-H | ||
B、氚原子符号:
| ||
C、Mg2+结构示意图: | ||
D、C2H4分子比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A的最简氢化物 | B的最简氢化物 | M的最简氢化物 | X的氧化物 | Y的最简氢化物分子构型 | Z的最高价氧化物 |
| 含氢量最高的有机物 | 水溶液呈碱性 | 水溶液呈酸性 | 两性氧化物 | 正四面体 | 对应的水化物为最强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| T/K | 298 | 398 | 498 |
| K/ | 4.1×106 | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间 (s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)mol/L | 0.10 | C1 | 0.050 | C3 | C4 |
| c(NO2)mol/L | 0.00 | 0.060 | C2 | 0.12 | 0.12 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com