

 CaCl2+2NH3↑+2H2O;故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;故答案为:2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O; 2SO3(g)△H=-196.6 kJ?mol-1 ;
2SO3(g)△H=-196.6 kJ?mol-1 ; 2SO3(g)△H=-196.6 kJ?mol-1
2SO3(g)△H=-196.6 kJ?mol-1

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
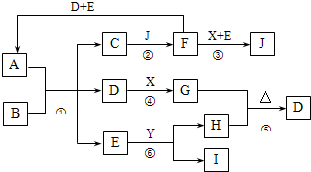 A是由四种短周期元素组成的正盐,X是黄绿色气体,D、F都是无色有刺激性气味的气体;气体I对H2的相对密度是13,且分子中各原子处于同一直线上;D、E分子都是10电子微粒.转化关系如下(部分产物省略):
A是由四种短周期元素组成的正盐,X是黄绿色气体,D、F都是无色有刺激性气味的气体;气体I对H2的相对密度是13,且分子中各原子处于同一直线上;D、E分子都是10电子微粒.转化关系如下(部分产物省略):
| ||
| ||
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:

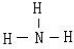
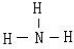
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A是由四种短周期元素组成的正盐,X是黄绿色气体,D、F都是无色有刺激性气味的气体;气体I对H2的相对密度是13,且分子中各原子处于同一直线上;D、E分子都是10电子微粒.转化关系如下(部分产物省略):
A是由四种短周期元素组成的正盐,X是黄绿色气体,D、F都是无色有刺激性气味的气体;气体I对H2的相对密度是13,且分子中各原子处于同一直线上;D、E分子都是10电子微粒.转化关系如下(部分产物省略):查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:
如下图所示的转化关系中(部分产物省略),A是由四种短周期元素组成的正盐,X是黄绿色气体,D、F都是无色有刺激性气味的气体;气体I对H2的相对密度是13,且分子中各原子处于同一直线上;D、E分子都是10电子微粒。
 |
![]()
请回答下列问题:
(1)J的化学式为 ,Y的电子式为 。
(2)反应③的离子方程式是 ,反应⑤的化学方程式是 。
(3)上述转化中,属于氧化还原反应的是(填编号) 。
(4)在450 ℃、催化剂存在下,4 mol F和2 mol O2反应放热353.9 kJ,此时,F的转化率为90 %,则该反应的热化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com