
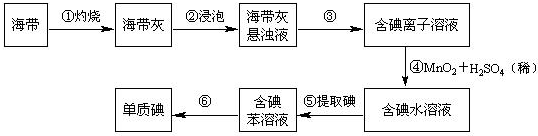

分析 以海带为原料获得少量碘单质:将海带在坩埚中灼烧得到海带灰,将海带灰浸泡得到海带灰悬浊液,然后采用过滤的方法将残渣和溶液分离,得到含有碘化钾的溶液,向水溶液中加入MnO2,发生反应为2I-+MnO2+4H+═Mn2++I2+2H2O,向含有碘单质的溶液中加入萃取剂苯萃取蒸馏得到碘单质.
(1)根据实验仪器的功能和使用方法进行判断,带有活塞或旋塞的仪器要检查是否漏水;
(2)根据实验操作步骤①灼烧来分析用到的实验仪器;
(3)根据实验操作步骤③过滤来分析用到的实验仪器;
(4)在酸性环境下,二氧化锰能将碘离子氧化为碘单质;
(5)根据萃取剂的选择原理来回答;
(6)实现沸点不同的互溶物质的分离应该采用蒸馏法,上图中还缺少的玻璃仪器是冷凝管、温度计.
解答 解:(1)a仪器为蒸馏烧瓶,带有活塞或旋塞的仪器要检查是否漏水,则题中分液漏斗和容量瓶使用前需要检验是否漏水,
故答案为:蒸馏烧瓶;bc;
(2)灼烧固体物质一般使用(瓷)坩埚,而坩埚加热需要用泥三脚支撑然后放在三脚架上,三脚架下面的空间放酒精灯,
故答案为:BDE;
(3)步骤③是分离固体和液体,则实验操作为过滤,故除铁架台、烧杯外,还需用到的仪器有漏斗、玻璃棒;
故答案为:漏斗、玻璃棒;
(4)在酸性环境下,二氧化锰能将碘离子氧化为碘单质,即2I-+MnO2+4H+═Mn2++I2+2H2O,Mn元素的化合价降低,MnO2作为氧化剂,
故答案为:氧化剂;
(5)萃取剂的选择原理:和水互不相溶,要萃取的物质在其中的溶解度大于在水中的溶解度,可以选择苯,
故答案为:苯与水、I2均不发生化学反应;苯与水互不相溶;碘在苯中的溶解度比在水中大;
(6)碘单质和苯的沸点不同,二者互溶,实现沸点不同的互溶物质的分离应该采用蒸馏法,蒸馏还缺少的玻璃仪器是冷凝管、温度计,
故答案为:蒸馏;冷凝管、温度计.
点评 本题考查了实验室里从海藻中提取碘的流程,侧重考查了物质的分离和提纯,掌握萃取、蒸馏等操作是解答本题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | SO2 | B. | FeS2 | C. | NaHSO3 | D. | SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取溴苯应用液溴、铁屑和苯混合,反应后先用水再用稀碱液洗涤 | |
| B. | 检验C2H5Cl中氯原子,将C2H5Cl和NaOH溶液混合加热后,加稀硫酸进行酸化 | |
| C. | 用无水乙醇和浓H2SO4共热至140℃可以制得乙烯气体 | |
| D. | 苯酚中滴加少量的稀溴水出现了三溴苯酚的白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴水不可用于鉴别苯、四氯化碳、乙醇三种无色液体 | |
| B. | 欲从溴水中分离出Br2,可将适量CCl4加入溴水中振荡静置分层后分液 | |
| C. | 配制一定物质的量浓度的硫酸溶液时,只需使用1次玻璃棒 | |
| D. | 氢气还原氧化铜实验先加热后通氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸钾制备实验中,将NaNO3和KCl的混合液加热并浓缩至有晶体析出,趁热过滤时,可以分离出硝酸钾 | |
| B. | 重结晶时,溶液冷却速度越慢得到的晶体颗粒越大 | |
| C. | 减压过滤操作时,应将滤纸放入布氏漏斗内,滤纸大小应略大于漏斗内径才能将全部小孔盖住 | |
| D. | 在两支试管中分别加1ml无水乙醇和1.5g苯酚固体,再加等量的钠,比较乙醇、苯酚羟基上氢原子的活泼性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com