
目前,医疗上使用放射性核素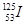 治疗肿瘤,该核素原子核内的中子数与电子数之差是
治疗肿瘤,该核素原子核内的中子数与电子数之差是
| A. 125 | B.72 | C.19 | D.53 |
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:单选题
短周期元素的离子aW2+、bX+、cY2-、dZ-具有相同的电子层结构,下列推断正确的是( )
| A.原子半径:W>X>Z>Y | B.热稳定性:H2Y>HZ |
| C.离子半径:W2+>Y2- | D.碱性:XOH>W(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
价电子总数与原子总数都相同的分子、离子或原子团称为等电子体,等电子体具有相似的结构和性质。下列选项中互称为等电子体的是
A.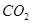 和 和 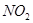 | B.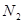 和 和  |
C.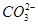 和 和 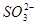 | D. 和 和 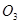 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
【化学———化学与技术】
锶(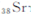 )元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与
)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与
和 同属于第ⅡA族?
同属于第ⅡA族?
(1)碱性:Sr(OH)2 Ba(OH)2(填“>”或“<”);锶的化学性质与钙和钡类似,用原子结构的观点解释其原因是 ?
(2)碳酸锶是最重要的锶化合物?用含SrSO4和少量BaSO4?BaCO3?FeO?Fe2O3?Al2O3?SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
Ⅰ.将天青石矿粉和Na2CO3溶液充分混合,过滤;
Ⅱ.将滤渣溶于盐酸,过滤;
Ⅲ.向Ⅱ所得滤液中加入浓硫酸,过滤;
Ⅳ.向Ⅲ所得滤液中先加入次氯酸,充分反应后再用氨水调pH约为7,过滤;
Ⅴ.向Ⅳ所得滤液中加入稍过量NH4HCO3,充分反应后,过滤,将沉淀洗净,烘干,得到SrCO3?
已知:ⅰ.相同温度时的溶解度:BaSO4<SrCO3<SrSO4<CaSO4
ⅱ.生成氢氧化物沉淀的pH 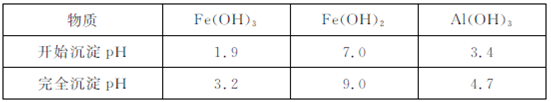
①Ⅰ中,反应的化学方程式是 ?
②Ⅱ中,能与盐酸反应溶解的物质有 ?
③Ⅳ的目的是 ?
④该工艺流程中NH4HCO3含有的化学键是 ?
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B原子的最外层电子数是其次外层电子数的2倍;A的一种原子中,质量数与质子数之差为零。D元素的原子最外层电子数为m,次外层电子数为n;E元素的原子L层电子数为m+n,M层电子数为m/2-n。请回答下列问题:
(1)D元素在周期表中的位置是_____________________;
(2)写出一个E和D形成的化合物与水反应的离子方程式_______________________;
(3)已知:甲 + H2O → 丙 + 丁。若甲是由N和Cl元素组成的化合物,其分子结构 模型如下图所示, 丙具有漂白性。则甲中Cl元素的化合价是 ,丁与H2O有相同的电子总数,则丁的化学式为 。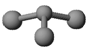
(4)与D同主族上下相邻的元素M、N,原子电子层数M>N>D,三种元素氢化物沸点由大到小的顺序是(填写化学式) 。
(5)写出B与D在高温下完全反应后生成物的电子式___ __ ,结构式___
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)Q、W、X、Y、Z均为元素周期表中前四周期元素,且其原子序数依次增大,Q元素的阳离子核外无电子,W元素原子的最外层电子数是其次外层电子数的2倍,Y是地壳中含量最多的元素,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
⑴W位于元素周期表第 周期第 族。Y的第一电离能 (填“大于”或“小于”)X的第一电离能。
⑵XQ3分子中的化学键类型为 (填“极性”或“非极性”)共价键,空间类型为 。Q—X﹑Q—Y﹑Q—W中键长最短的是 。
⑶Z的基态原子核外电子排布式是 ,Z的单质与X的最高价氧化物对应水化物的稀溶液反应的离子方程式为 。
⑷已知:①WQ4(g) +4XY2(g) ﹦4XY(g)+WY2 (g)+2Q2Y(g) △H﹦-574KJ·mol-1
②WQ4(g) +4XY(g) ﹦2X2 (g) +WY2 (g) +2Q2Y(g) △H﹦-1160KJ·mol-1
则由WQ4还原XY2生成X2的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大。A、D同主族;B、D、E三种元素原子的最外层电子数之和为10;E的单质可做半导体材料;C与E两元素形成的化合物可与A、C、D形成的化合物Y发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M。1molM中含有42mol电子。回答下列问题:
(1) E元素在周期表中的位置 ;化合物M中含有的化学键类型有
(2)比较B、C、E形成的气态氢化物的稳定性由强到弱的顺序是
(用化学式表示);写出C与A形成的18e-化合物的电子式 ,
该化合物类型为 (填“共价化合物”或“离子化合物”)
(3)写出C与E两元素形成的化合物与Y溶液反应的离子方程式
;写出题中生成M的化学方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com