
| A. | 该氖原子的相对原子质量是12$\frac{a}{b}$ | B. | 该氖原子的摩尔质量是aNAg | ||
| C. | Wg该氖原子的物质的量是$\frac{W}{{a{N_A}}}$mol | D. | Wg该氖原子所含质子数是10W/a |
分析 A.原子相对原子质量等于1个原子质量与1个12C原子的$\frac{1}{12}$比值;
B.摩尔质量以g/mol为单位,氖原子摩尔质量数值上等于阿伏伽德罗常数个氖原子的质量;
C.根据n=$\frac{m}{M}$计算;
D.结合1个Ne原子质量计算Wg该氖原子含有原子数目,氖原子含有10个质子.
解答 解:A.氖原子质量是a g,12C的原子质量是b g,则该氖原子相对原子质量=$\frac{ag}{\frac{1}{12}×b}$=$\frac{12a}{b}$,故A正确;
B.“g”是质量的单位,氖原子质量是a g,NA是阿伏加德罗常数的值,则氖原子摩尔质量为aNAg/mol,故B错误;
C.Wg该氖原子的物质的量是=$\frac{Wg}{a{N}_{A}g/mol}$=$\frac{W}{a{N}_{A}}$mol,故C正确;
D.氖原子质量是a g,则Wg该氖原子含有原子数目=$\frac{Wg}{ag}$=$\frac{W}{a}$,氖原子含有10个质子,故含有质子数目为$\frac{10W}{a}$,故D正确;
故选:B.
点评 本题考查相对原子质量、摩尔质量、微粒数目计算等,比较基础,以物质的量为核心的相关概念及计算公式是解题关键,注意理解掌握相对原子质量的计算.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
 向容积固定的容器甲和带有活塞的定压容器乙中分别通入2mol SO2和1mol O2(如下图),若开始通气时两容器的体积相同,在相同温度下反应,一段时间后,反应达到平衡.则下列说法正确的是( )
向容积固定的容器甲和带有活塞的定压容器乙中分别通入2mol SO2和1mol O2(如下图),若开始通气时两容器的体积相同,在相同温度下反应,一段时间后,反应达到平衡.则下列说法正确的是( )| A. | 平衡时,两容器内SO3的浓度必定相等 | |
| B. | 平衡时,混合气体中的SO3的体积分数甲比乙高 | |
| C. | SO2的转化率乙容器内比甲容器内高 | |
| D. | 反应后的相同时间内,甲容器中的反应速率大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
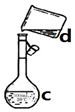 (1)现需配制0.1mol/LNaOH溶液500mL,装置是某同学转移溶液的示意图
(1)现需配制0.1mol/LNaOH溶液500mL,装置是某同学转移溶液的示意图查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水中只含Cl2和H2O分子 | |
| B. | 新制氯水不能使干燥的有色布条褪色 | |
| C. | 光照氯水有气泡逸出,该气体是Cl2 | |
| D. | 新制氯水可使蓝色石蕊试纸先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCCl4含有NA个分子 | |
| B. | 0.1mol/L的HNO3中有0.1NA个H+ | |
| C. | 常温常压下,8gO2含有4NA个电子 | |
| D. | 1molNa被完全氧化生成Na+,失去2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大理石与醋酸反应制取二氧化碳:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 氯乙酸与足量氢氧化钠溶液共热:CH2ClCOOH+OH-→CH2ClCOO-+H2O | |
| C. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O | |
| D. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)△H
(1)已知可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)△H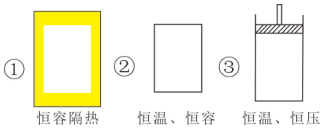
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com