
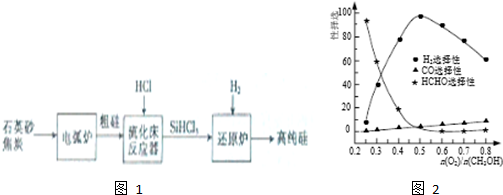
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
分析 (1)根据氮化硅中各元素的原子最外层达到8电子稳定结构分析;
(2)氮氧化物与水反应生成硝酸,能形成酸雨,此外还形成光化学烟雾、臭氧层破坏;NO2在碱性条件下自身发生氧化还原反应生成硝酸钠和亚硝酸钠;
(3)①石英砂主要成分为二氧化硅,二氧化硅和碳在高温的条件下反应生成碳化硅和一氧化碳;
②根据题中数据,采用精馏(或蒸馏)方法提纯SiHCl3;
(4)根据1mol硅完全燃烧能放出910kJ的热量书写热化学方程式,“硅能源”具有环保及储存、运输方便的特点;
(5)当n(O2)/n(CH3OH)=0.25时,CH3OH与O2发生的主要反应为甲醇的催化氧化生成甲醛;n(O2)/n(CH3OH)>0.5时,氧气过量,与氢气反应生成水;
解答 解:(1)氮化硅中各元素的原子最外层达到8电子稳定结构,Si原子最外层电子数为4,N原子最外层电子数为5,要形成8电子稳定结构,则应有二者个数比值为3:4,其化学式为Si3N4,
故答案为:Si3N4;
(2)氮氧化物与水反应生成硝酸,能形成酸雨,此外还形成光化学烟雾、臭氧层破坏;NO2在碱性条件下自身发生氧化还原反应生成硝酸钠和亚硝酸钠,反应的离子方程式为:2NO2+2OH-═NO3-+NO2-+H2O,
故答案为:酸雨、光化学烟雾、臭氧层破坏(任一点均可);2NO2+2OH-═NO3-+NO2-+H2O;
(3)①石英砂的主要成分是二氧化硅,在反应中生成碳化硅,反应为:SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑,
故答案为:SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑;
②利用沸点的不同提纯SiHCl3属于蒸馏,SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和SiH2Cl2(沸点8.2℃),SiH3Cl(沸点-30.4℃),由于沸点差别较大,可以通过精馏(或蒸馏)除去杂质,
故答案为:精馏(或蒸馏);
(4)1mol硅完全燃烧能放出910kJ的热量,热反应方程式为:Si(S)+O2(g)═SiO2(S)△H=-910KJ/mol,硅为固体,则“硅能源”具有产物不污染环境及储存、运输方便的特点,
故答案为:Si(S)+O2(g)═SiO2(S)△H=-910KJ/mol;产物不污染环境,储存、运输方便;
(5)根据图象可知,当n(O2)/n(CH3OH)=0.25时,CH3OH与O2发生的主要反应为甲醇的催化氧化生成甲醛,反应的方程式为:2CH3OH+O2$→_{△}^{催化剂}$2HCHO+2H2O,n(O2)/n(CH3OH)>0.5时,氧气过量,与氢气反应生成水,H2选择性下降,
故答案为:2CH3OH+O2$→_{△}^{催化剂}$2HCHO+2H2O;氧气过量,与氢气反应生成水;
点评 本题考查较综合,侧重考查了氮和硅及其化合物的有关知识,注意粗硅的提纯反应原理,注意图象正确分析,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 钠和钾的合金具有导电性,可用于中子反应堆热交换剂 | |
| B. | 采用催化措施,将汽车尾气中的CO和NO转化为无害气体 | |
| C. | 信息产业中的光缆的主要成分是单质硅 | |
| D. | 水玻璃易溶于水,可用于生产黏合剂和防火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池放电过程中,负极质量一定减轻,正极质量一定增加 | |
| B. | 常温下浓硫酸与铝不反应,所以常温下可用铝制贮罐贮运浓硫酸 | |
| C. | 8NH3(g)+6NO2(g)=7N2(g)+12 H2O(g)△H<0该反应一定能自发进行 | |
| D. | 提取海带中的碘元素时,为将I-完全氧化为I2,用HNO3作氧化剂比用H2O2效果好 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铝、铁及其化合物在工业生产中有着重要的应用.
铝、铁及其化合物在工业生产中有着重要的应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2可用作供氧剂 | |
| B. | 硅胶多孔,吸水能力强,常用作袋装食品的干燥剂 | |
| C. | SO2具有漂白性,常用药食品的漂白 | |
| D. | K2FeO4可用于水的净化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质溶液中混入水,会影响电池反应 | |
| B. | 反应中,SOCl2既是溶剂,又是氧化剂 | |
| C. | 电池工作过程中,亚硫酰氯(SOCl2) 被还原为Li2SO3 | |
| D. | 电池工作过程中,金属锂提供的电子与正极区析出硫物质的量之比为4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH=4 CH3COOH溶液加水稀释10倍,溶液中各离子浓度均减小 | |
| B. | 用 CH3COOH溶液滴定等物质的量浓度的NaOH溶液至pH=7,V(CH3COOH溶液)<V(NaOH溶液) | |
| C. | 向0.2 mol/L的盐酸溶液中加入等体积0.1 mol•L-1NH3•H2O溶液:c(Cl-)+c(OH-)=c(H+)+c(NH3•H2O) | |
| D. | 在含0.1mol NaHSO4溶液中:c(H+)=c(SO42-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
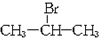 ;
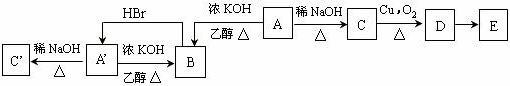
;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com