
| A、酸式滴定管用蒸馏水洗涤后,又用标准液润洗 |
| B、滴定过程中锥形瓶中振荡,有液体溅出 |
| C、滴定完毕,滴定管尖端外挂有液滴 |
| D、滴定前仰视读数,滴定终点俯视读数 |
| c(标注)×V(标准) |
| V(待测) |
| c(标注)×V(标准) |
| V(待测) |
| c(标注)×V(标准) |
| V(待测) |
| c(标注)×V(标准) |
| V(待测) |
| c(标注)×V(标准) |
| V(待测) |


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V (盐酸)/mL(初始) | 0.00 | 0.20 | 0.10 | 0.10 |
| V (盐酸)/mL(终点) | 20.98 | 21.22 | 21.10 | 21.12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有AlO2-的溶液中:Na+、Al3+、NO3-、Cl- |
| B、使淀粉碘化钾变蓝的溶液中:K+、HCO3-、S2-、SO42- |
| C、能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、Na+ |
| D、通有SO2的溶液中:Fe2+、Mg2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
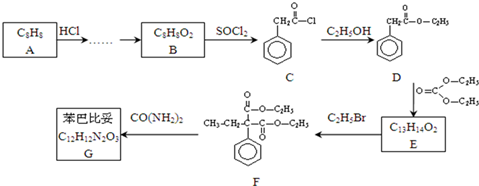



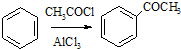 ,请设计合理方案以B的同系物
,请设计合理方案以B的同系物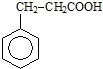 为原料合成
为原料合成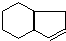 (用合成路线流程图表示为:A
(用合成路线流程图表示为:A| 反应试剂 |
| 反应条件 |
| 反应试剂 |
| 反应条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(B+)>c(A-)>c(OH-)>c(H+) |
| B、c(A-)>c(B+)>c(H+)>c(OH-) |
| C、c(B+)=c(A-)>c(H+)=c(OH-) |
| D、c(B+)>c(A-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向久置的氯水中滴入紫色石蕊试液,溶液将先变红后褪色 |
| B、欲除去Cl2中少量HCl气体,可将此混合气体通过盛饱和食盐水的洗气瓶 |
| C、漂白粉有效成分是CaCl2和Ca(ClO)2,应密闭保存 |
| D、SO2和Cl2都具有漂白作用,所以将两种气体同时作用于潮湿有色物质,可大大增强漂白作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com