
| A. | S | B. | Na | C. | Si | D. | Cl |
科目:高中化学 来源: 题型:选择题
| 反应物 | 反应条件1 | 反应条件2 | |
| A | CH3CHICH3 | NaOH的水溶液,加热 | NaOH的乙醇溶液,加热 |
| B | 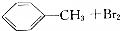 | 光照 | 铁粉 |
| C | 乙醇+氧 | 点燃 | Cu做催化剂,加热 |
| D | 乙烯 | 溴水 | 溴的四氯化碳溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 低温、高压、催化剂 | B. | 高温、高压 | ||
| C. | 尽可能的高温、高压 | D. | 适宜的温度、高压、催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.060 |
| t1 | 0.012 | |
| t2 | 0.016 |
| A. | 反应在0~t1 min内的平均速率为v(SO3)=0.088/t1 mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.10 mol SO3和0.010 mol O2,到达平衡时,n(SO2)=0.012 mol | |
| C. | 保持其他条件不变,升高温度,平衡时c(SO2)=0.007 0 mol•L-1,则反应的△H>0 | |
| D. | 相同温度下,起始时向容器中充入0.050 mol SO2和0.030 mol O2,达到平衡时SO2转化率大于88% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
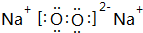 ;属于离子化合物(填“离子”或“共价”);
;属于离子化合物(填“离子”或“共价”); ;属于共价化合物(填“离子”或“共价”);
;属于共价化合物(填“离子”或“共价”);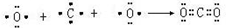 ;
;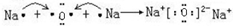 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
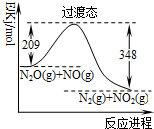
| A. | 使用催化剂可以降低过渡态的能量 | |
| B. | 反应物能量之和大于生成物能量之和 | |
| C. | N2O(g)+NO(g)→N2(g)+NO2(g)+139kJ | |
| D. | 反应物的键能总和大于生成物的键能总和 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选 项 | A | B | C | D |
| 实验操作或装置 | 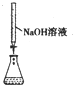 | 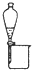 | 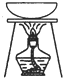 |  |
| 实验目的 | 准确量取25.00mLNaOH溶液 | 分离乙醇与乙酸乙酯 | 从KI和I2的混合物中回收I2 | 实验室制取SO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com