
| A. | 0.2mol/L的硫酸10mL | B. | 0.25mol/L的盐酸20mL | ||
| C. | 18.4mol/L的硫酸30mL | D. | 0.3mol/L的硝酸20mL |
科目:高中化学 来源: 题型:选择题
| A. | 2HgO $\frac{\underline{\;\;△\;\;}}{\;}$ 2Hg+O2↑ | |
| B. | 2Al2O3 $\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑ | |
| C. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | |
| D. | K2O+H2$\frac{\underline{\;高温\;}}{\;}$2K+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸与氢氧化钠溶液反应:H++OH-═H2O | |
| B. | 铁丝与硫酸铜溶液反应:Fe+Cu2+═Fe2++Cu | |
| C. | 氯化亚铁溶液和氯气反应:Fe2++Cl2═Fe3++2Cl- | |
| D. | 氯化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验序号 | 起始读数/mL | 终点读数/mL |
| Ⅰ | 2.50 | 22.58 |
| Ⅱ | 1.00 | 23.12 |
| Ⅲ | 0.00 | 19.92 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
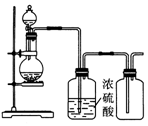
| A. | 亚硫酸钠固体与硫酸反应制二氧化硫 | |
| B. | 铜与稀硝酸反应制一氧化氮 | |
| C. | 氯化铵与氢氧化钙固体反应制氨气 | |
| D. | 锌和稀硫酸反应制氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,30 g乙烷气体中所含有的共价键数目为6NA | |
| B. | 常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4NA | |
| C. | 常温下,1 L pH=12的氨水溶液中含有NH4+数目为0.01NA | |
| D. | 1mol乙酸和1mol乙醇充分反应生成的水分子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com