
【题目】下列说法不具有因果关系的是( )
A. 明矾溶于水后生成氢氧化铝胶体,因此具有净水能力
B. 纯碱水溶液呈碱性,因此可以去油污
C. 二氧化硅与氢氧化钠溶液反应生成硅酸钠,因此装氢氧化钠溶液的试剂瓶不能用玻璃塞
D. ![]() 具有漂白性,因此能使酸性高锰酸钾溶液褪色
具有漂白性,因此能使酸性高锰酸钾溶液褪色
科目:高中化学 来源: 题型:
【题目】氮的化合物在生产生活中广泛存在。
(1)①氯胺(NH2Cl)的电子式为________。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如右表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH=_________。
化学键 | 键能/(kJ·mol-1) |
N-H | 391.3 |
Cl-Cl | 243.0 |
N-Cl | 191.2 |
H-Cl | 431.8 |
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为____________(填“放热”或“吸热”)反应。
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)=_________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、B两点的浓度平衡常数关系:Kc(A)_____Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是______(填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=______(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用黄铁矿(FeS2)为原料制备硫酸的流程如下:
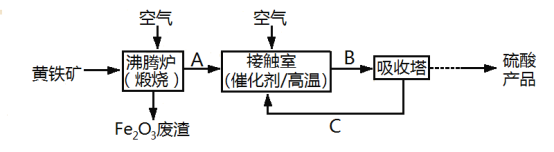
回答下列问题:
(1)在接触室中发生的反应是2SO2+O2![]() 2SO3,该反应属于__________(填字母)
2SO3,该反应属于__________(填字母)
a.氧化还原反应 b.离子反应
c.化合反应 d.可逆反应
(2)Fe2O3废渣的用途有________________________(答出一条即可)。
(3)写出沸腾炉中发生反应的化学方程式:________
(4)取硫酸产品加入蔗糖中,有“黑面包”现象发生,该过程体现出浓硫酸的性质是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】旋烷是一类比较特殊的碳氢化合物,其张力较大。如下给出了几种旋烷的结构。下列说法不正确的是( )
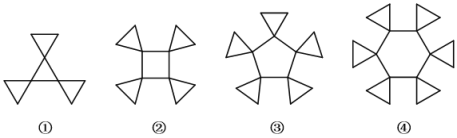
A.旋烷①与三甲苯互为同分异构体
B.旋烷②的二氯代物种类数小于其十四氯代物的种类数
C.1 mol旋烷③完全燃烧时消耗20 mol O2,生成10 mol H2O
D.旋烷系列分子中含碳量为0. 9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向100mL饱和的H2S溶液中通入SO2气体(气体体积换算成标准状况),发生反应:2H2S+SO2=3S↓+2H2O,测得溶液pH与通入SO2的关系如图所示。下列有关说法正确的是
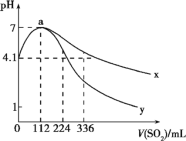
A.整个过程中,水的电离程度逐渐增大
B.该温度下H2S的Ka1数量级为10-7
C.曲线y代表继续通入SO2气体后溶液pH的变化
D.a点之后,随SO2气体的通入,![]() 的值始终减小
的值始终减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜是一种常见的化工产品,它在纺织、印染、医药、化工、电镀以及木材和纸张的防腐等方面有极其广泛的用途。实验室制备硫酸铜的步骤如下:
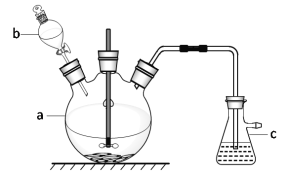
①在仪器a中先加入20 g铜片、60 mL水,再缓缓加入 17 mL浓硫酸;在仪器b中加入39 mL浓硝酸;在仪器c中 加入20%的石灰乳150 mL。
②从仪器b中放出约5 mL浓硝酸,开动搅拌器,然后采用滴加的方式逐渐将浓硝酸加到仪器a中,搅拌器间歇开动。当最后一滴浓硝酸加完以后,完全开动搅拌器,等反应基本停止下来时,开始用电炉加热直至仪器a中的红棕色气体完全消失,立即将导气管从仪器c中取出,再停止加热。
③将仪器a中的液体倒出,取出未反应完的铜片,溶液冷却至室温,析出蓝色晶体。
试回答下列问题:
(1)仪器b的名称为_______;将仪器b中液体滴入仪器a中的具体操作是_____________。
(2)写出仪器a中反应的化学方程式:________________。
(3)步骤②中将导气管先从仪器c中取出再停止加热的目的是____________________。
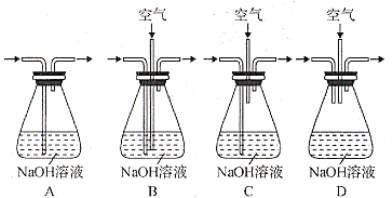
(4)为提高尾气吸收,防止空气污染,下列装置___________(填字母)适合吸收逸出的气体(反应中产生的气体因来不及被石灰乳吸收而逸出)。
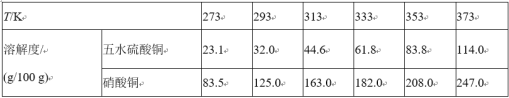
(5)根据表中五水硫酸铜和硝酸铜在不同温度下的溶解度,分析步骤③中溶液冷却至室温析出蓝色晶体的主要原因:_________。除去硫酸铜晶体中的少量硝酸铜可采用____________方法,检验硝酸铜是否被除净的方法:_____________。
(6)本实验采用硝酸氧化法制取硫酸铜,工业上也常采用将铜在450 ℃左右焙烧,再与一定浓度的硫酸反应制取硫酸铜的方法。采用硝酸氧化法的优点在于__________________。
(7)用滴定法测定蓝色晶体中Cu2+的含量。取a g试样配成 100 mL 溶液,每次取 20. 00 mL,用 c mol L-1 EDTA (H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。 滴定反应为Cu2++ H2Y2-→CuY2-+2H+。计算蓝色晶体中Cu2+质量分数w=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物I(4-对羟基苯基-2-丁酮)是国际公认的既安全又获广泛应用的合成香料。由化合物A制备I的一种合成路线如下:

回答下列问题:
(1)A的化学名称为________________。
(2)B中的官能团名称是_________________。
(3)F的结构简式为_______________。
(4)⑤的反应类型是________________。
(5)写出满足下列条件的G的同分异构体的结构简式:______________。
i.属于芳香族化合物;
ii.既能发生银镜反应,又能发生水解反应;
iii.核磁共振氢谱为三组峰,峰面积比为6︰2︰1。
(6)设计由氯乙烷和丙二酸制备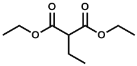 的合成路线:______(无机试剂任选)。
的合成路线:______(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,反应后固体物质增重的是
A. 氢气通过灼热的CuO粉末 B. 二氧化碳通过Na2O2粉末
C. 铝与Fe2O3发生铝热反应 D. 将锌粒投入Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列萃取与分液结合进行的操作(用![]() 作萃取剂,从碘水中萃取磺)错误的是( )
作萃取剂,从碘水中萃取磺)错误的是( )
A.碘水和![]() 加入分液漏斗后,盖好玻璃塞,右手压住分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来振荡
加入分液漏斗后,盖好玻璃塞,右手压住分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来振荡
B.静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(准备放出液体)
C.打开分液漏斗的活塞,使下层液体全部沿盛接液体的烧杯内壁慢慢流出
D.最后继续打开活塞,另用容器盛接并保存上层液体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com