
| 弱酸 | HCN | HF | CH3COOH | HNO2 |
| 电离常数 | 4.9×10-10 | 7.2×10-4 | 1.8×10-5 | 6.4×10-6 |
| A. | HCN | B. | HF | C. | CH3COOH | D. | HNO2 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
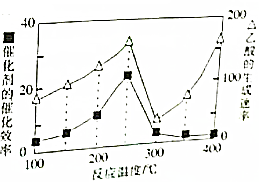 用甲烷和二氧化碳可以制备化工原料.
用甲烷和二氧化碳可以制备化工原料.| 物质 | H2 | CO | CH4 | CH3COOH |
| 燃烧热(KJ/mol) | 286 | 283 | 890 | 874 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标况下将112mL氯气通入10mL 1mol•L-1的碘化亚铁溶液中:Cl2+2I-═2Cl-+I2 | |
| B. | 用FeS去除工厂废水中的Hg2+:Hg2++S2-═HgS↓ | |
| C. | NaHSO3溶液中投入过氧化钠粉末:4HSO3-+2Na2O2═4SO32-+O2↑+4Na+ | |
| D. | 用醋酸除去水壶中的水垢:CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
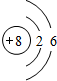 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向橙色的K2Cr2O7溶液中加适量的浓硫酸充分振荡后橙色变深 | |
| B. | 向装有少量Na2S2O3溶液的试管中滴加适量稀硫酸充分振荡后无明显变化 | |
| C. | 向装有淀粉和KI溶液的试管中滴加适量H2SO4充分振荡后溶液变蓝 | |
| D. | 向装有少量H2O2溶液的试管中加适量CuSO4溶液充分振荡后产生大量气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1L溶液中含有0.2NA个NO3- | |
| B. | 1L溶液中所含的阴、阳离子总数为0.6NA个 | |
| C. | 0.5L溶液中Ba2+浓度是0.1mol/L | |
| D. | 500mL溶液中,含有NO3-的物质的量为0.2mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com