
分析 依据n=$\frac{m}{M}$=$\frac{V}{Vm}$=CV计算解答,注意摩尔质量以g/mol为单位,数值上与相对分子质量相等.
解答 解:标准状况下,112mL某气体物质的量为$\frac{0.112L}{22.4L/mol}$=0.005mol,摩尔质量M=$\frac{0.14g}{0.005mol}$=28g/mol,所以其相对分子质量为28,将其完全溶于水配成2L溶液,则该溶液的物质的量浓度为:$\frac{0.005mol}{2L}$=0.0025mol/L;
故答案为:28 g/mol,28,0.0025mol/L.
点评 本题考查了物质的量的计算,熟悉以物质的量为核心的相关计算公式是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属比非金属易失电子,所以金属可以置换非金属,而非金属不能置换金属 | |
| B. | 变价金属一定是过渡元素 | |
| C. | 不含金属元素的化合物也可能是离子化合物 | |
| D. | 显酸性的溶液中溶质只能是酸或强酸弱碱盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 嫦娥一号 | 液氢(H2) | ①2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1 ②2H2(l)+O2(l)=2H2O(g)△H=-482.6kJ•mol-1 |
| 祥云火炬 | 丙烷 (C3H8) | ③C3H8(l)+5O2(g)=3CO2(g)+4H2O(g)△H=-2013.8kJ•mol-1 ④C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2221.5kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
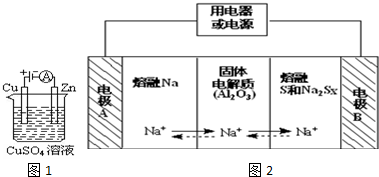
 过氧化氢和臭氧都是常见的绿色氧化剂,工业生产中有着重要用途.
过氧化氢和臭氧都是常见的绿色氧化剂,工业生产中有着重要用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,18gH218O所含质子数为10NA | |
| B. | 1 mol乙醇中含有极性键的数目为8NA | |
| C. | 1mol的-NH2与1molNH4+所含电子数均为10NA | |
| D. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24LH2O含有的分子数等于0.1NA | |
| B. | 标准状况下,2.24L Cl2通入足量NaOH溶液中,反应转移电子的数目为0.1NA | |
| C. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| D. | 18g重水(D2 O)所含的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两个反应均为氧化还原反应 | |
| B. | CO2与SO2不能用澄清石灰水鉴别 | |
| C. | CO2分子中各原子最外层均为8电子稳定结构 | |
| D. | 相同条件下:2CO(g)+SO2(g)=S(g)+2CO2(g)△H=+270kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com