
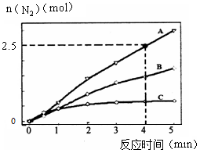
 氨在生活、生产、科研中有广泛用途.
氨在生活、生产、科研中有广泛用途.分析 (1)依据热化学方程式和盖斯定律计算①+②-③得到CO2与NH3合成尿素和液态水的热化学反应方程式;
(2)①已知4分钟时氮气为2.5mol,根据v(N2)=$\frac{△c}{△t}$计算;
②A.相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低;
B.催化剂改变反应速率不改变化学平衡;
C.单位时间内H-O键断裂表示逆速率,N-H键断裂表示正速率,正逆速率相同则反应已经达到平衡;
D.该反应为放热反应,恒容绝热的密闭容器中,反应时温度会升高,则K会减小;
(3)①平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
②可逆反应AgCl (s)+2NH3(aq)=Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数 K=$\frac{c(C{l}^{-})c(Ag(N{H}_{3}{)_{2}}^{+})}{{c}^{2}(N{H}_{3})}$=$\frac{c(C{l}^{-})c(Ag(N{H}_{3}{)_{2}}^{+})}{{c}^{2}(N{H}_{3})}$×$\frac{A{g}^{+}}{Ag+}$=Ksp(AgCl)×K稳计算,;1L 1mol/L氨水中最多可以溶解AgCl可以依据化学平衡常数计算;
(4)氨、丙烯和空气为原料,一定条件下合成丙烯腈(CH2═CH-CN)的方程式为:2CH2=CH-CH3+2NH3+3O2→CH2=CH-CN+6H2O;丙烯腈溶于足量稀硫酸中可生成丙烯酸(CH2=CH-COOH)和硫酸铵,该反应的离子方程式为CH2=CH-CN+2H2O+H+→CH2=CH-COOH+NH4+.
解答 解:(1)①2NH3(g)+CO2(g)→NH2CO2 NH4(s)+l59.5kJ•mol-1
②NH2CO2NH4(s)→CO(NH2)2(s)+H2O(g)-116.5kJ•mol-1
③H2O(l)→H2O(g)-44.0kJ•mol-1
依据热化学方程式和盖斯定律计算①+②-③得到CO2与NH3合成尿素和液态水的热化学反应方程式为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87.0KJ/mol;
故答案为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87.0KJ/mol;
(2)①已知4分钟时氮气为2.5mol,则生成的N2为2.5mol,所以v(N2)=$\frac{△c}{△t}$=$\frac{\frac{2.5mol}{2L}}{4min}$═0.3125mol•L-1•min-1,
故答案为:0.3125mol•L-1•min-1;
②A.相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低,所以该反应的活化能大小顺序是:Ea(A)<Ea(B)<Ea(C),故A错误;
B.使用催化剂A达平衡时,改变反应速率不改变化学平衡,N2最终产率不变,故B错误;
C.单位时间内H-O键断裂表示逆速率,N-H键断裂表示正速率,单位时间内H-O键与N-H键断裂的数目相等时,则消耗的NH3和消耗的水的物质的量之比为4:6,则正逆速率之比等于4:6,说明反应已经达到平衡,故C正确;
D.该反应为放热反应,恒容绝热的密闭容器中,反应时温度会升高,则K会减小,当K值不变时,说明反应已经达到平衡,故D正确;
故答案为:CD;
(3)①Ag+(aq)+2NH3(aq)=Ag(NH3)2+(aq),该反应平衡常数的表达式=$\frac{Ag(N{H}_{3}{)_{2}}^{+}}{c(A{g}^{+}){c}^{2}(N{H}_{3})}$;
故答案为:$\frac{c(C{l}^{-})c(Ag(N{H}_{3}{)_{2}}^{+})}{{c}^{2}(N{H}_{3})}$;
②可逆反应AgCl (s)+2NH3(aq)=Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数 K=$\frac{c(C{l}^{-})c(Ag(N{H}_{3}{)_{2}}^{+})}{{c}^{2}(N{H}_{3})}$=$\frac{c(C{l}^{-})c(Ag(N{H}_{3}{)_{2}}^{+})}{{c}^{2}(N{H}_{3})}$×$\frac{A{g}^{+}}{Ag+}$=Ksp(AgCl)×K=1.76×10-10×1.10×107=1.936×10-3,设溶解的AgCl物质的量为x,反应前后系数相同,可以用物质的量代替平衡浓度计算平衡常数,
AgCl (s)+2NH3(aq)=Ag(NH3)2+(aq)+Cl-(aq),
依据平衡常数=$\frac{c(C{l}^{-})c(Ag(N{H}_{3}{)_{2}}^{+})}{{c}^{2}(N{H}_{3})}$=$\frac{{x}^{2}}{(1-2x)^{2}}$=1.936×10-3,
1-2x≈1,计算得到x=0.044mol,
故答案为:1.936×10-3,0.044;
(4)由氨、丙烯和空气为原料,一定条件下合成丙烯腈方程式为:2CH2=CH-CH3+2NH3+3O2→CH2=CH-CN+6H2O;丙烯腈溶于足量稀硫酸中可生成丙烯酸(CH2=CH-COOH)和硫酸铵,该反应的离子方程式为CH2=CH-CN+2H2O+H+→CH2=CH-COOH+NH4+.
故答案为:2CH2=CH-CH3+2NH3+3O2→CH2=CH-CN+6H2O;CH2=CH-CN+2H2O+H+→CH2=CH-COOH+NH4+.
点评 本题考查了热化学方程式书写方法和盖斯定律计算应用、化学平衡影响因素分析判断、平衡常数和溶度积常数计算的应用、反应速率计算、平衡状态的判断等,题目难度中等,侧重于考查学生对基础知识的综合应用能力.


科目:高中化学 来源: 题型:解答题
| 方法I | 用炭粉在高温条件下还原CuO生成Cu2O和CO2 |
| 方法II | 用肼(N2H4)还原新制Cu(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工厂排放 CO2会导致酸雨的形成 | |
| B. | 使用含有氯化钙的融雪剂会加速桥梁的腐蚀 | |
| C. | “山东疫苗案”涉及疫苗未冷藏储运而失效,这与蛋白质变性有关 | |
| D. | 《黄白第十六》中有“曾青涂铁,铁赤如铜”,这与化学变化有关 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上10月月考化学试卷(解析版) 题型:选择题
如图锥形瓶中装满了c mol·L-1的Na2SO4溶液,经测定其中含有a mol SO42-,则锥形瓶容积为( )

A.a/c L B.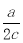 L C.ac L D.2ac L
L C.ac L D.2ac L
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.54×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳和碳的化合物在生产、生活中的应用非常广泛. 现将不同量的CO2(g)和H2(g)分别通入体积为2L的恒容密闭容器中,进行如下反应:CO2(g)+H2(g)?CO(g)+H2O(g),得到如下三组数据:
碳和碳的化合物在生产、生活中的应用非常广泛. 现将不同量的CO2(g)和H2(g)分别通入体积为2L的恒容密闭容器中,进行如下反应:CO2(g)+H2(g)?CO(g)+H2O(g),得到如下三组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| CO2 | H2 | CO | |||
| 1 | 800 | 4 | 2.5 | 1.5 | 5 |
| 2 | 830 | 2 | 2 | 1 | 3 |
| 3 | 830 | 2 | 2 | 1 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
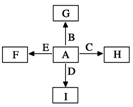 如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物. ,它的空间构型是直线型分子;
,它的空间构型是直线型分子;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com