

| A. | 该物质的分子式为SN | |
| B. | 该物质熔、沸点较低 | |
| C. | 该物质分子中所有原子的最外层均达到稳定结构 | |
| D. | 该物质与化合物S2N2互为同素异形体 |
分析 分子晶体的熔沸点一般较低,在化合物中非金属元素间易形成极性键,同种非金属元素间易形成非极性键;由同种元素组成的不同单质互称同素异形体,同素异形体首先必须是单质,据此分析.
解答 解:A.该分子中含有4个N原子、4个S原子,其化学式为S4N4,故A错误;
B.该物质属于分子晶体,分子晶体的熔沸点一般较低,故B正确;
C.N原子最外层有5个电子,要形成8电子稳定结构,应该形成3个共价键,而分子中N原子只形成了2个共价键,所以N原子的最外层没达到稳定结构,故C错误;
D.同种元素的不同单质互为同素异形体,S4N4和S2N2都是化合物不是单质,所以不是同素异形体,故D错误;
故选B.
点评 本题考查分子晶体、化学键、8电子稳定结构、同素异形体等基本概念,明确概念内涵是解本题关键,知道同素异形体、同位素、同分异构体概念之间的差别,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 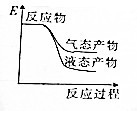 | B. | 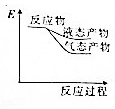 | C. | 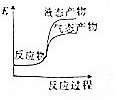 | D. | 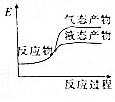 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
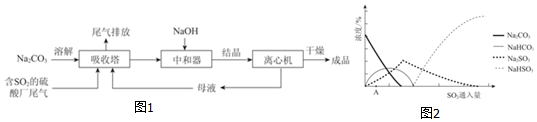
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
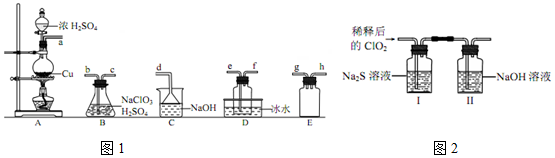
| 操作步骤 | 实验现象 | 结论 |
| 取少量I中溶液于试管甲中,滴加品红溶液和盐酸 | 品红始终不褪色 | ①无SO2(或HSO3-或SO32-)生成 |
| 另取少量I中溶液于试管乙中,加入Ba(OH)2溶液,振荡 | ②白色沉淀 | 有SO42-生成 |
| ③继续在试管乙中滴加Ba(OH)2溶液至过量,静置,取上层清液于试管丙内 加入足量稀硝酸酸化的硝酸银溶液 | 有白色沉淀生成 | 有Cl-生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
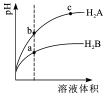 常温下,各取1mL,PH=2的,两种二元酸H2A与H2B,分别加水稀释,PH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )
常温下,各取1mL,PH=2的,两种二元酸H2A与H2B,分别加水稀释,PH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )| A. | H2A的酸性比H2B弱 | |
| B. | C点溶液的导电性比a、b点溶液的导电性都强 | |
| C. | 若0.1mol•L-1NaHA溶液的PH=4,离子浓度大小为c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(H+)>c(OH-) | |
| D. | N2B的水溶液中,离子浓度大小为c(Na+)>c(B2-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com