
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
分析 0.1mol该有机物分别与足量的钠、足量的碳酸氢钠溶液反应,生成标准状况下的气体分别为2.24L即0.1molH2、2.24L即0.1molCO2,说明有机物分子中含有1个羧基,1个羟基,先写出丁酸的同分异构体,然后连接上羟基.
解答 解:0.1mol该有机物分别与足量的钠、足量的碳酸氢钠溶液反应,生成标准状况下的气体分别为2.24L即0.1molH2、2.24L即0.1molCO2,说明有机物分子中含有1个羧基,1个羟基,丁酸的同分异构体:CH3CH2CH2C00H,CH3CHC00HCH3,连接上羟基可得同分异构体:CH2OHCH2CH2C00H,CH3CHOHCH2C00H,CH3CH2CHOHC00H,CH2OHCH(C00H)CH3,CH3C(OHC00H)CH3,共有5种,
故选C.
点评 本题主要考查了同分异构体的书写,准确判断官能团的种类是解题的关键,难度不大.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
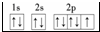 ;E3+的离子符号为Fe3+.
;E3+的离子符号为Fe3+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
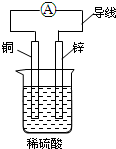
| A. | 锌片为负极,铜片为正极 | |
| B. | 该装置能将电能转化为化学能 | |
| C. | 铜片发生的反应为Cu-2e-═Cu2+ | |
| D. | 电流方向是由锌片通过导线流向铜片 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.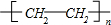 (或CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH).
(或CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ②⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某微粒空间构型为三角锥形,则该微粒一定是极性分子 | |
| B. | 某微粒空间构型为V形,则中心原子一定有孤电子对 | |
| C. | NH4+中N-H键能、键长和键角均相同 | |
| D. | SiF4和SO${\;}_{3}^{2-}$的中心原子均为sp3杂化,其立体构型都是正四面体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) | |
| B. | 在0.1mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | |
| C. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol•L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com