
【题目】(本题共10分)研究燃料的燃烧和对污染气体产物的无害化处理,对于防止大气污染有重要意义。
(1)将煤转化为清洁气体燃料。已知:
H2(g)+1/2O2(g)=H2O(g) ![]() H= 242.0 kJ/mol
H= 242.0 kJ/mol
C(s)+1/2O2(g)=CO(g) ![]() H= 110.0 kJ/mol
H= 110.0 kJ/mol
①写出焦炭与水蒸气反应制H2和CO的热化学方程式 。
②已知在101kPa时,CO、 H2和CH4的燃烧热分别为283kJ/mol、286 kJ/mol和892kJ/mol。则反应CH4(g)+ H2O(g) ![]() CO(g)+3H2(g)△H= kJ/mol。
CO(g)+3H2(g)△H= kJ/mol。
(2)已知一定温度和压强下,由H2和CO反应合成优质燃料甲醇:
CO(g)+2H2(g)![]() CH3OH(g)△H=-91kJ/mo1
CH3OH(g)△H=-91kJ/mo1
①在相同条件下要想得到182kJ热量,加入各物质的物质的量可能是 。
A.2mo1 CO和4mol H2 B.2mo1 CO、4mol H2和1mol CH3OH(g)
C.4mo1 CO和4mol H2 D.4mo1 CO和6mol H2
②将1mol CO和2mol H2充入一密闭容器中,保持恒温恒压时进行反应,达到平衡时,测得CO的转化率为20%。若在相同条件下,起始时在该容器中充入1mol CH3OH(g),反应达到平衡时的热量变化是 (填“吸收”或“放出”) kJ热量。
【答案】(本题共10分)(每空2分)
(1) ① C(s)+H2O(g)=CO(g)+H2(g) ![]() H=+132kJ/mol ②△H= +205kJ/mol
H=+132kJ/mol ②△H= +205kJ/mol
(2) ① D;② 吸收 72.8
【解析】
试题分析:(1)①由盖斯定律,反应二减去反应一得C(s)+ H2O(g)= CO(g)+H2(g) ![]() H= 110.0 kJ/mol-(242.0 kJ/mol)=+132 kJ/mol;②液态水变为气态水吸热44 kJ/mol,△H=283kJ/mol+3×286 kJ/mol -892kJ/mol-44 kJ/mol =+205 kJ/mol;(2)①反应生成2mol甲醇时放热182kJ,则有2molCO,4molH2参加反应,投料量CO大于2mol,H2大于4mol,答案选D;②正反应为放热反应,逆反应为吸热反应,对于等效平衡,从不同方向建立平衡时,转化率之和为1,故应吸收的热量为91kJ/mol×1mol×(1-20%)=72.8kJ。
H= 110.0 kJ/mol-(242.0 kJ/mol)=+132 kJ/mol;②液态水变为气态水吸热44 kJ/mol,△H=283kJ/mol+3×286 kJ/mol -892kJ/mol-44 kJ/mol =+205 kJ/mol;(2)①反应生成2mol甲醇时放热182kJ,则有2molCO,4molH2参加反应,投料量CO大于2mol,H2大于4mol,答案选D;②正反应为放热反应,逆反应为吸热反应,对于等效平衡,从不同方向建立平衡时,转化率之和为1,故应吸收的热量为91kJ/mol×1mol×(1-20%)=72.8kJ。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 中和10 mL 0.1molL-1醋酸与中和100 mL 0.01molL-1的醋酸所需同种碱溶液的用量不同
B. 两种醋酸溶液的物质的量浓度分别c1和c2,pH分别为a和a+1,则c1=10c2
C. 常温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D. 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国本土科学家屠呦呦因为发现青蒿素而获得2015年的诺贝尔生理和医学奖.已知二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( ) 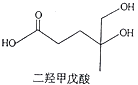
A.与乙醇发生酯化反应生成产物的分子式为C8H18O4
B.能发生加成反应,不能发生取代反应
C.在铜的催化下与氧气反应的产物可以发生银镜反应
D.标准状况下1mol该有机物可以与足量金属钠反应产生22.4L H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列短周期元素相关性质的数据:
元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
原子半径(10﹣10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 |
最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | |
最低负化合价 | ﹣2 | ﹣3 | ﹣1 | ﹣3 |
试回答下列问题:
(1)元素⑤在周期表中的位置;
(2)元素④与元素⑦相比较,气态氢化物较稳定的是(填结构式);
(3)元素④形成的+3和+5价的氯化物中,各原子均达到8电子稳定结构的化合物是(写化学式);
(4)以下叙述正确的是 .
A.氢化物的沸点为④<⑦
B.①与②形成的化合物具有两性
C.与稀盐酸反应单质②比单质⑥快
D.最高价氧化物对应水化物的碱性③>⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一支25mL酸式滴定管中盛盐酸,液面恰好在amL刻度处,把管内液体全部放出,盛入量筒内,所得液体体积一定是( )
A.a mL
B.(25﹣a)mL
C.大于(25﹣a)mL
D.大于a mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaC1O2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下: 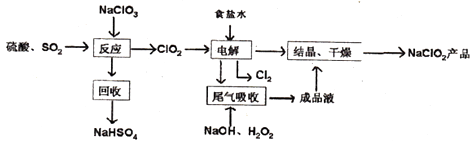
回答下列问题:
(1)“电解”所用食盐水由粗盐水精制而成,精制对,为除去Mg2+和Ca2+ , 要加入的试剂分别为、 .
(2)写出“反应”步骤中生成ClO2的化学方程式 .
(3)实验所用原料硫酸是由浓硫酸稀释而获得,写出实验过程 .
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2 . 此吸收反应中,氧化剂与还原剂的物质的量之比为 .
(5)将lmolSO2和lmolC12通入水中形成lL的溶液,所得溶液中氢离子浓度为mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用碳酸钠晶体(Na2CO310H2O)来配制1.0molL﹣1 Na2CO3溶液500mL,假如其他操作均准确无误,下列情况会引起所配溶液浓度偏高的是( )
A.称取碳酸钠晶体53.0g
B.移液时,对用于溶解碳酸钠晶体的烧杯没有进行冲洗
C.定容时,俯视观察刻度线
D.定容后,将容量瓶反复倒转、摇匀、静置时发现液面低于刻度线,于是又加入少量水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )
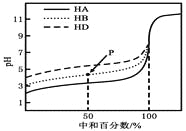
A. 三种酸的电离常数关系:KHA>KHB>KHD
B. 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com