
| A. | 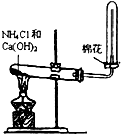 制备少量氨气 | B. | 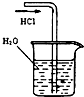 吸收HCl | ||
| C. |  分离苯和乙醇的混合物 | D. |  制备并收集少量NO2气体 |
分析 A.铵盐与碱共热生成氨气,氨气的密度比空气的小,利用向下排空气法收集;
B.HCl极易溶于水,易发生倒吸;
C.温度计用于测量馏分的温度;
D.二氧化氮能与水反应.
解答 解:A.铵盐与碱共热生成氨气,采用固体加热装置,又氨气的密度比空气的小,利用向下排空气法收集,由图可知,导管伸到试管的底部,故A正确;
B.HCl极易溶于水,易发生倒吸,应在烧杯中放置倒扣的漏斗来防止水倒吸,故B错误;
C.温度计位置错误,应位于蒸馏烧瓶的支管口附近,故C正确;
D.二氧化氮能与水反应,则不能利用排水法收集二氧化氮,故D错误;
故选AC.
点评 本题考查化学实验方案的评价,为高频考点,涉及气体的制备、收集以及物质的分离等,把握物质的性质及实验原理为解答的关键,注意实验的评价性分析,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据如图回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据如图回答下列问题: (填电子式),B
(填电子式),B (填结构式),E
(填结构式),E (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅①②③④ | B. | 仅②③④ | C. | 仅①③⑤ | D. | 仅②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 min时,M的转化率为80% | |
| B. | 4 min时,用M表示的反应速率为0.8 mol•L-1•min-1 | |
| C. | 4 min后,向容器中充入不参与反应的稀有气体,M的物质的量减小 | |
| D. | 2 min时,M的物质的量浓度为0.6 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
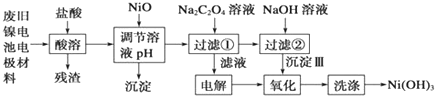
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 尽管NO2能与水反应生成硝酸,但NO2不属于酸性氧化物 | |
| B. | Na2O2粉末加入到FeSO4溶液中,产生白色沉淀,并放出大量气泡 | |
| C. | 氨气和氯化氢气体混合后生成的NH4Cl是离子化合物,因此该反应为离子反应 | |
| D. | 往酸性KMnO4溶液中通入SO2验证SO2的漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| A. | ①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小 | |
| B. | 分别加水稀释10倍,四种溶液的pH ①>②>④>③ | |
| C. | VaL④与VbL②溶液混合后,若混合后溶液pH=4,则Va:Vb=9:11 | |
| D. | ①、④两溶液等体积混合,所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com