
(1)写出NaClO与CH3COOH反应的离子方程式:___________________________。
(2)NaClO(或HClO)氧化菌体细胞后的还原产物是什么?_________(写化学式)。
(3)NaClO(s)还能氧化浓盐酸为Cl2,写出其反应的化学方程式:_______________。
解析:(1)发生复分解反应,方程易得。离子方程式,CH3COOH、HClO都是弱酸,不可拆。
(2)NaClO(或HClO)中Cl元素的化合价为+1,被还原,化合价降低,降为0价还是降为-1价;显然是后者,因为即使降为0价,还原产物Cl2还是能与H2O作用生成HCl和HClO,得结果相当于NaClO(或HClO)转化为了HCl(或NaCl)。
(3)NaClO氧化HCl为Cl2,本身也被还原为Cl2:
如果将稀NaClO(aq)与稀HCl(aq)混合;则发生下列反应:
NaClO+HCl![]() NaCl+HClO
NaCl+HClO
因为稀盐酸还原性弱,NaClO(aq)不能氧化稀盐酸。
答案:(1)ClO-+CH3COOH![]() CH3COO-+HClO
CH3COO-+HClO
(2)Cl-(或NaCl,或HCl)
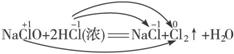
(3)NaClO+2HCl(浓)![]() NaCl+Cl2↑+H2O
NaCl+Cl2↑+H2O


科目:高中化学 来源:学习周报 化学 人教课标高一版(必修1) 2009-2010学年 第11期 总第167期 人教课标版 题型:022
下图是自来水厂净化水的过程示意图.
(提示:消毒剂利用了物质的强氧化性)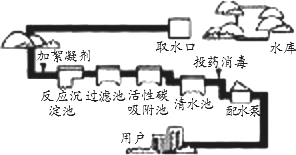
(1)该厂使用明矾作絮凝剂净水的原理是________.
(2)近年来发现,絮凝剂含有对人体有害的物质,长期饮用可能会引起老年性痴呆症.现在改用Na2FeO4代替絮凝剂和消毒剂,理由是________.此外,Na2FeO4可以利用NaClO在碱性条件下与Fe(OH)3反应制备,反应的离子方程式为________.
查看答案和解析>>
科目:高中化学 来源:2013届吉林省长春市十一中高三上学期期初考试化学试卷(带解析) 题型:实验题
根据环保要求,在处理有氰电镀废水时,剧毒的CN-离子在催化剂TiO2颗粒作用下,先用NaClO在碱性条件下将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2。环保工作人员在密闭系统中用下图装置进行实验,测定CN-被处理的百分率。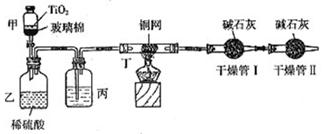
现将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.2mol/L)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)根据题意,写出有关主要反应的离子方程式:
甲中的反应:
乙中的反应:
(2)上述实验是通过测定CO2的量来确定对CN-的处理效果。丙装置中的试剂是 ,丁装置的目的是 ;干燥管Ⅰ的作用是 ,干燥管Ⅱ的作用是
(3)假定上述每一个装置都充分吸收,则利用该装置测得的CN-被处理的百分率与实际值相比 (填:“偏高”或“偏低”),简述可能的原因:
(4)若干燥管Ⅰ中碱石灰增重1.408g,则该实验中测得CN-被处理的百分率为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年吉林省长春市高三上学期期初考试化学试卷(解析版) 题型:实验题
根据环保要求,在处理有氰电镀废水时,剧毒的CN-离子在催化剂TiO2颗粒作用下,先用NaClO在碱性条件下将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2。环保工作人员在密闭系统中用下图装置进行实验,测定CN-被处理的百分率。
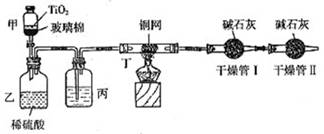
现将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.2mol/L)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)根据题意,写出有关主要反应的离子方程式:
甲中的反应:
乙中的反应:
(2)上述实验是通过测定CO2的量来确定对CN-的处理效果。丙装置中的试剂是 ,丁装置的目的是 ;干燥管Ⅰ的作用是 ,干燥管Ⅱ的作用是
(3)假定上述每一个装置都充分吸收,则利用该装置测得的CN-被处理的百分率与实际值相比 (填:“偏高”或“偏低”),简述可能的原因:
(4)若干燥管Ⅰ中碱石灰增重1.408g,则该实验中测得CN-被处理的百分率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
A~N均为中学化学中的常见物质,其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料,单质M是目前使用量最大的金属,常温下B、E、F为气体,G为无色液体,这些物质在一定条件下存在如下转化关系,其中有些反应物或生成物已经略去。回答下列问题:
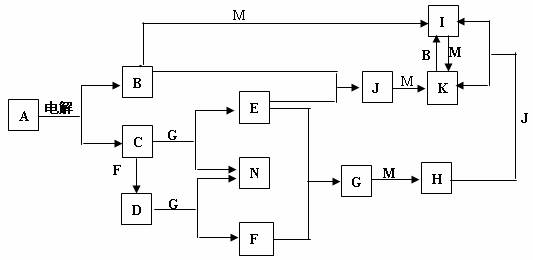
(1)H的化学式为 ,D的电子式为 。
(2)K转变为I的离子方程式: 。
(3)D与G反应的化学方程式为 。
(4)I可用于净水,其原因是
(用相关的反应方程式和简要文字回答)。
(5)1mol气体E在气体F中完全燃烧生成液态G时放出的热量为a kJ,请写出表示E燃烧热的热化学方程式 。
(6)I与NaClO在碱性条件下反应,是制备理想的绿色水处理剂(Na2MO4)的一种方法,试写出此反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com