
| A. | 2mol/L MgCl2溶液 | B. | 2.5mol/L NaCl溶液 | ||
| C. | 1mol/L AlCl3溶液 | D. | 5mol/L KClO3溶液 |
分析 氯离子的物质的量浓度与溶液体积大小无关,与溶质化学式组成及溶质的物质的量浓度有关,注意KClO3在溶液中电离出氯酸根离子和钾离子,不存在氯离子,据此对各选项进行计算.
解答 解:A.2mol/L MgCl2溶液中氯离子的物质的量浓度为:2mol/L×2=4mol/L;
B.2.5mol/L NaCl溶液中氯离子的浓度为2.5mol/L;
C.1mol/L AlCl3溶液中氯离子的物质的量浓度为:1mol/L×3=3mol/L;
D.KClO3溶液中电离出钾离子和氯酸根离子,不存在氯离子;
根据分析可知,氯离子的浓度最大的为A,
故选A.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式为解答关键,注意氯离子的浓度与溶质组成、溶质化学式有关,D为易错点,注意氯酸钾溶液中不存在氯离子.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:解答题
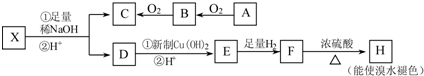
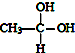 →CH3-CHO+H2O
→CH3-CHO+H2O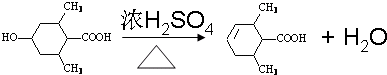 ;
;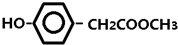 等.
等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
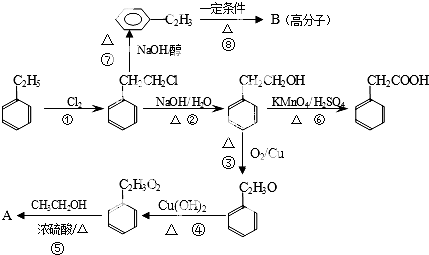
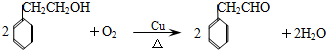
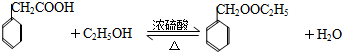
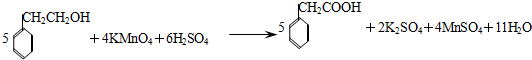

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有羟基的有机物都能与醋酸发生酯化反应 | |
| B. | 氨基酸、乙酸和苯酚都能与氢氧化钠溶液反应 | |
| C. | 醇类、卤代烃都能发生消去反应 | |
| D. | 除饱和烃之外的其他烃都能发生聚合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
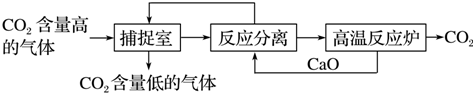
| A. | 生产过程中,可循环利用的物质有CaO和NaOH | |
| B. | 该方法涉及了化合、分解和复分解等反应类型 | |
| C. | 该方法通过化学变化,分离、提纯并利用CO2,可以减少碳的排放 | |
| D. | “反应分离”环节中,分离物质的基本操作是蒸发、结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与漂白粉溶液反应的离子方程式:Ca2++SO32-═CaSO3↓ | |
| B. | 通入SO2至过量:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| C. | 通入HCl至溶液pH=7:c(HSO3-)<c(Cl-) | |
| D. | 加入NaOH固体可使溶液中水的电离程度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| B. | 用FeCl3溶液腐蚀铜来制作印刷电路板:2Fe3++Cu═2Fe2++Cu2+ | |
| C. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| D. | 向Al (SO4)3溶液中加入过量的NH3•H2O:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH=6的H2SO4 稀释1000倍后,c(H+)=2 c(SO42-) | |
| B. | 0.1 mol L-1的 Na2CO3溶液中:c(OH- )=c(HCO3- )+c(H+)+c(H2CO3) | |
| C. | 浓度均为0.1 mol L-1的 NaClO 溶液和 CH3COONa 溶液中,c(ClO-)<c(CH3COO-) | |
| D. | 浓度分别为0.1 mol L-1和0.01 mol L-1的CH3COOH溶液中:c(CH3COO-)前者是后者的10倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com