
【题目】下列状态的氯中,电离最外层一个电子所需能量最大的是( )
A.[Ne]3s1B.[Ne]3s23p5C.[Ne]3s23p3D.[Ne]3s2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】t ℃,体积固定的密闭容器中,发生反应A(g)+3B(g)![]() 2C(g),开始充入1 mol A和3 mol B,达平衡后再充入2 mol C,则平衡
2C(g),开始充入1 mol A和3 mol B,达平衡后再充入2 mol C,则平衡
A. 正向移动 B. 逆向移动
C. 不移动 D. 再次达新平衡时,C的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。
(1)25 ℃,1.00 g N2H4 (l)与足量N2O4 (l)完全反应生成N2 (g)和H2O (l),放出19.14 kJ的热量。则反应2N2H4 (l)+N2O4 (l)=3N2 (g)+4H2O (l)的△H= __________ kJ/mol。
(2)已知:2NO2(g)![]() N2O4(g) △H=-57.20 kJ/mol。一定温度下,在密闭容器中反应2NO2(g)
N2O4(g) △H=-57.20 kJ/mol。一定温度下,在密闭容器中反应2NO2(g)![]() N2O4(g)达到平衡。
N2O4(g)达到平衡。
①其他条件不变时,下列措施能提高NO2转化率的是 ________。
A.升高温度 B.降低温度 C.增加NO2的浓度 D.扩大容器体积
②平衡时,c(NO2)=0.0300 mol/L、c(N2O4)=0.0120 mol/L。若升高温度,则平衡常数____________(填“增大”、“减小”或“不变”);若起始NO2和N2O4的浓度均为0.0100 mol/L,则v(正)______v(逆)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化符合图示的是( )
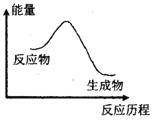
①KMnO4分解制O2 ②铝与盐酸的反应
③钠与水反应 ④二氧化碳与灼热的木炭反应
⑤Ba(OH)2·8H2O和NH4Cl的反应.⑥硫酸与氢氧化钾的反应
A. ②④⑥B. ②③⑤C. ②③⑥D. ③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机合成中ffi重要试剂,可由NO与Cl2在常温常压(或稍低温度)下合成,其熔点-64.5℃,沸点-5.5℃,遇水易水解。实验室模拟制备装置如图所示(部分夹持装置省略),D中三颈烧瓶置于-10℃冰盐水中。

经查阅资料:NO与NaOH溶液不反应,但NO2+NO+2NaOH =2NaNO2+H2O
(1)仪器甲的名称是________。
(2)图示装置中恒压漏斗与分液漏斗相比,其优点为___________。
(3) NOC1分子中各原子均满足8电子稳定结构,则NOCl的电子式为_________。
(4)实验开始时,先打开K1、K2,关闭K3,打开分液漏斗活塞滴入适量稀硝酸,至C中红棕色完全消失后,关闭K1、K2,此时装置C的作用为___________。滴入适量浓盐酸,点燃酒精灯,当_______(填装置符号)中充满黄绿色气体时,打开K1、K3,制备NOC1。

(5)装置乙中装有无水CaCl2,其作用为_______;丙为尾气处理装置,则最佳选择为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求填空:
(1)FeSO4可转化为FeCO3,FeCO3在空气中加热可制得铁系氧化物材料。已知25℃,101kPa时:4Fe(s)+3O2(g)
=2Fe2O3(s)ΔH=-1648kJ/mol,C(s)+O2(g)=CO2(g) ΔH=-393kJ/mol,2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480kJ/mol,FeCO3在空气中加热反应生成Fe2O3的热化学方程式为_______。
(2)一定条件下,向容积可变的密闭容器中通入N2和H2,发生反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0达到平衡后,试回答下列问题:
2NH3(g) ΔH<0达到平衡后,试回答下列问题:
①达到平衡后,若其它条件不变,把容器体积缩小一半,平衡将____(填“向逆反应方向”、“向正反应方向”或“不”)移动,平衡常数K将_____ (填“增大”、“减小”或“不变”)。
②达到平衡后,在恒压条件下,向容器中通人氦气(He),氮气的转化率将___(填“增大”、“减小”或“不变”)。
(3)AlCl3溶液加热蒸干并灼烧最终得到物质是________(填化学式),将NaHCO3与Al2(SO4)3溶液混合后可做泡沫灭火剂,其原理是_______(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容中加入2.0molSO2和1.0molO2,一定条件下发生如下反应2SO2+O2![]() 2SO3。反应达到平衡后,各物质的物质的量可能为( )
2SO3。反应达到平衡后,各物质的物质的量可能为( )
n(SO2)/mol | n(O2)/mol | n(SO3)/mol | |
A | 2.0 | 1.0 | 0 |
B | 1.0 | 0.8 | 1.0 |
C | 0.20 | 0.10 | 1.80 |
D | 0 | 0 | 2.0 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com