Ⅰ.硅是信息产业、太阳能电池光电转化的基础材料.锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意图如图:
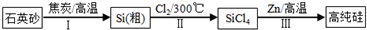
(1)焦炭在过程Ⅰ中做
剂.
(2)过程Ⅱ中Cl
2用电解饱和食盐水制备,制备Cl
2的化学方程式为
.
(3)整过生产过程必须严格控制无水.
①SiCl
4遇水剧烈水解生成SiO
2和一种酸,反应方程式为
.
②干燥Cl
2时从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H
2SO
4中.冷却的作用是
.
(4)Zn还原SiCl
4的反应如下:
反应①:400℃~756℃,SiCl
4(g)+2Zn
(l)?Si
(S)+2ZnCl
2(l)△H
1<0
反应②:756℃~907℃,SiCl
4(g)+2Zn
(l)?Si
(S)+2ZnCl
2(g)△H
2<0
反应③:907℃~1410℃,SiCl
4(g)+2Zn
(g)?Si
(S)+2ZnCl
2(g)△H
3<0
i.反应②的平衡常数表达式为
.
ii.对于上述三个反应,下列说明合理的是
.
a.升高温度会提高SiCl
4的转化率 b.还原过程需在无氧的气氛中进行
c.增大压强能提高反应速率 d.Na、Mg可以代替Zn还原SiCl
4.
(5)用硅制作太阳能电池时,为减弱光在硅表面的反射,可用化学腐蚀法在其表面形成粗糙的多孔硅层.腐蚀剂常用稀HNO
3和HF的混合液.硅表面首先形成SiO
2,最后转化成H
2SiF
6.用化学方程式表示SiO
2转化为H
2SiF
6的过程
.
Ⅱ.(1)甲烷、氢气、一氧化碳的燃烧热分别为a kJ?mol
-1,b kJ?mol
-1,c kJ?mol
-1,工业上利用天燃气和二氧化碳反应制备合成气(CO、H
2),其热化学反应方程式为
.
(2)已知Ksp(AgCl)=1.8×10
-10,Ksp(AgI)=1.5×10
-16,Ksp(Ag
2CrO
4)=2.0×10
-12,三种难溶盐的饱和溶液中,Ag
+浓度大小的顺序为
.



 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案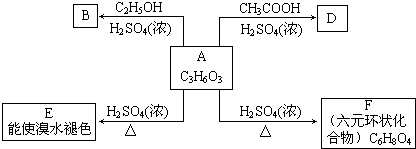
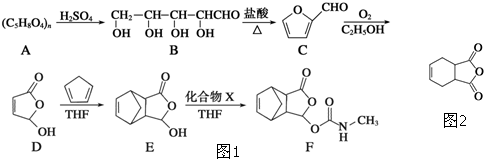
 化合物G(结构如图2所示)是合成抗病毒药阿昔洛韦的中间体.请写出以OHCCH(Br)CH2CHO和1,3-丁二烯为原料制备G的合成路线流程图2(无机试剂任用).合成路线流程图示例如下:H2C=CH2
化合物G(结构如图2所示)是合成抗病毒药阿昔洛韦的中间体.请写出以OHCCH(Br)CH2CHO和1,3-丁二烯为原料制备G的合成路线流程图2(无机试剂任用).合成路线流程图示例如下:H2C=CH2
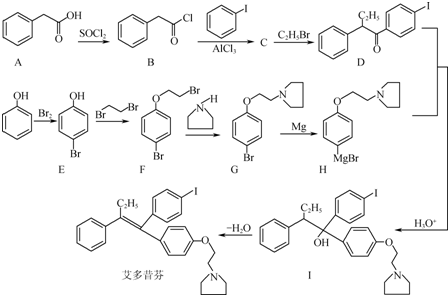
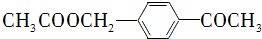 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C═CH2
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C═CH2