
| A、12.5% | B、25% |
| C、50% | D、75% |
| 7 |
| 2 |
| 5 |
| 2 |
| 9 |
| 2 |
| 7 |
| 2 |
| 5 |
| 2 |
| 9 |
| 2 |
| 1 |
| 1+1 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、1.12g |
| B、6.42g |
| C、2.24g |
| D、3.24g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a=b=c |
| B、2a=2b=c |
| C、a=b=2c |
| D、都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氟元素半径小,电负性高,可与金属或非金属生成最高价化合物,如MnF2、SF6等.
氟元素半径小,电负性高,可与金属或非金属生成最高价化合物,如MnF2、SF6等.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、藻类大量繁殖,抢走了鱼类的营养 |
| B、水中缺氧,窒息而死 |
| C、水中氧气过多 |
| D、水中含有有毒的金属元素过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
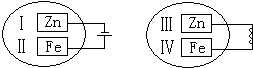 把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示平面图),经过一段时间后,两个实验中,观察到的现象和对应方程式都正确的是( )
把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示平面图),经过一段时间后,两个实验中,观察到的现象和对应方程式都正确的是( )| A、Ⅰ附近溶液变红,Zn-2e-=Zn2+ |
| B、Ⅳ附近溶液变红,O2+2H2O+4e-=4OH- |
| C、Ⅱ附近有黄绿色气体生成,2Cl--2e-=Cl2↑ |
| D、Ⅲ附近有无色气体生成,2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1 NaOH溶液:K+、Ba2+、Cl-、HCO3- |
| B、0.1 mol?L-1 Na2CO3溶液:K+、NH4+、NO3-、SO42- |
| C、0.1 mol?L-1 FeCl3溶液:K+、Na+、I-、SCN- |
| D、0.1 mol?L-1 HCl的溶液:Ca2+、Na+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
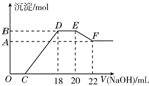 探究实验发现,硝酸发生氧化还原反应时,浓度越稀,对应还原产物中氮元素的化合价越低.
探究实验发现,硝酸发生氧化还原反应时,浓度越稀,对应还原产物中氮元素的化合价越低.查看答案和解析>>
科目:高中化学 来源: 题型:
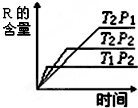 在密闭容器中进行下列反应:M(g)+N(g)R(g)+2L,反应符合右图.下列叙述正确的是( )
在密闭容器中进行下列反应:M(g)+N(g)R(g)+2L,反应符合右图.下列叙述正确的是( )| A、T2>T1,正反应放热,L是液体 |
| B、P2<P1,正反应吸热,L是固体 |
| C、T2<T1,正反应放热,L是气体 |
| D、P2>P1,正反应吸热,L是气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com