
【题目】某化学反应:2A![]() B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
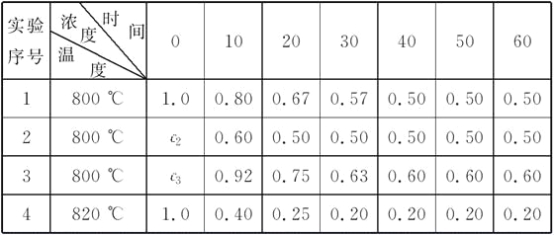
根据上述数据,完成下列填空:
(1)在实验1中,反应在10至20 min时间内A的平均速率为________mol·L-1·min-1。
(2)在实验2中,A的初始浓度c2=__________mol·L-1,反应经20 min就达到平衡,可推测实验2中还隐含的条件是
________________________________________________________________________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3________v1(填“>”、“=”或“<”),且c3________1.0 mol·L-1(填“>”、“=”或“<”)。
(4)比较实验4和实验1,可推测该反应是________反应(选填“吸热”或“放热”)。理由是
________________________________________________________________________。
【答案】0.013 1.0 使用了催化剂 > > 吸热 温度升高时,平衡向右移动
【解析】
(1)v(A)=![]() =0.013 mol·L-1·min-1。
=0.013 mol·L-1·min-1。
(2)对比实验1与实验2可知,平衡时A的浓度相等,确定1、2为等效平衡,即c2=1.0 mol·L-1,且2先达平衡状态,反应的速率快,说明反应中使用了催化剂。
(3)对比实验3与实验1可知,从10 min到20 min,实验1的A的浓度变化值为0.13 mol·L-1,而实验3的A浓度变化值为0.17 mol·L-1,这就说明了v3>v1。又知从0 min 到10 min A的浓度变化值应大于0.17 mol·L-1,即c3>(0.92+0.17) mol·L-1=1.09 mol·L-1。
(4)对比实验4与实验1可知,两实验的起始浓度相同,反应温度不同,达平衡时实验4中A的浓度小,说明了实验4中A进行的程度大,即温度越高,A的转化率越大,说明正反应为吸热反应。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是
A. 用Na2S处理含Hg2+废水:Hg2+ + S2 = HgS↓
B. 燃煤中添加生石灰减少SO2的排放:2CaO + O2 + 2SO2 ![]() 2CaSO4
2CaSO4
C. 工业上将Cl2 通入石灰乳中制漂白粉:Cl2 + OH- = Cl-+ ClO- + H2O
D. 向漂白液中加入适量洁厕灵(含盐酸),产生氯气:ClO-+ Cl-+2H+ = Cl2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)![]() 2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol·L-1
其中正确的是:
A.①③B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活社会发展息息相关。下列说法错误的是( )
A.![]() 的乙醇和84消毒液的消毒原理不相同
的乙醇和84消毒液的消毒原理不相同
B.制造N95口罩的聚丙烯树脂属于无机非金属材料
C.玛瑙的主要成分是二氧化硅,陶瓷的主要成分是硅酸盐
D.海轮船体镶嵌锌块是牺牲阳极的阴极保护法,防止船体被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

(1)通过计算,可知系统(I)和系统(II)制氢的热化学方程式分别为__________________ 、______________________,制得等量H2所需能量较少的是___________。
(2)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g)。在610K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率a1=_____ %,反应平衡常数K =___________。
②在620K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率a2 _____________a1,该反应的H __________0。(填“>” “<” 或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是 _____ (填标号)。
A.H2S B.CO2 C.COS D.N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示的转化关系,回答下列问题:

(1)写出反应①的离子方程式:______________________________________________;写出反应②的离子方程式:______________________。
(2)推出下列物质的化学式:E____________;I______________。
(3)在上述转化过程中,B、C、F、H的氧化能力由弱到强的顺序为______________________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物9,10-二甲基菲的结构如图所示,下列关于该物质的说法正确的是

A. 该物质分子式为C16H12
B. 该物质与甲苯互为同系物
C. 该物质能与溴水发生取代反应和加成反应
D. 该物质苯环上七氯代物的同分异构体有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以CH4、CO2为原料合成乙酸,是综合开发温室气体资源的新方向。
I.CH4.CO2催化重整间接制乙酸
CH4、CO2催化重整制合成气,再利用合成气制乙酸,涉及的反应如下:
反应l:CH4(g)+CO2(g) 2H2(g)+2CO(g)△H
反应2:2H2(g)+CO(g) CH3OH(g)△H=-90.9kJ·mol-1
反应3:CH3OH(g)+CO(g) CH3COOH(g)△H=-118.2kJ·mol-1
(1)已知:CH4(g)+CO2(g) CH3COOH(g)△H=+37.9kJ·mol-1则“反应l”的△H=_________
(2)“反应1”的化学反应速率v=k[![]() ]m·[
]m·[![]() ]n,k为速率常数。1123K和1173K时,分别保持
]n,k为速率常数。1123K和1173K时,分别保持![]() 或
或![]() 不变,测得速率v与
不变,测得速率v与![]() 、
、![]() 的关系如图所示:
的关系如图所示:
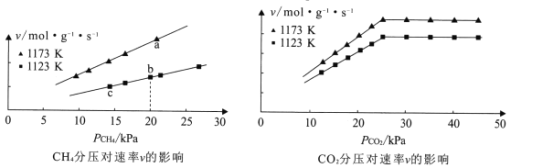
①由图可知,下列叙述正确的是_________(填标号)。
A.当10kPa≤![]() ≤25kPa时,m=l
≤25kPa时,m=l
B.其他条件不变,增大![]() ,速率v不一定增大
,速率v不一定增大
C.a、b、c三点速率常数的大小关系为:ka>kb>kc
②若初始时按n(CH4):n(CO2)=1:1进气,且Kb=1.3×10-2mol·g-1·s-1·Kpa-2,则b点的化学反应速率v=_________mol·g-1·s-1。
(3)向盛有催化剂的刚性容器中通入等物质的量的CH4(g)和CO2(g),发生“反应1”。在923K和1173K时,CH4(g)的转化率(α)与时间(t)的关系如图所示。
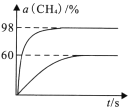
923K时,CH4(g)的平衡转化率α=_________,若平衡时体系的总压强为p0,平衡常数K923K=____(用含有p0的代数式表示)。
II.CH4、CO2两步法制乙酸
(4)反应CH4(g)+CO2(g)CH3COOH(g)不能自发进行。将该反应拆分成两个连续的步骤进行,可在较温和的条件下实现上述转化,具体过程:
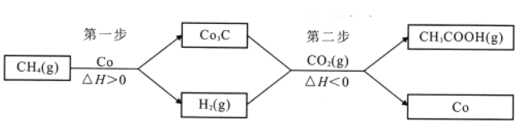
①第二步反应的化学方程式为_________
②为增大CH3COOH的平衡产率,从温度角度考虑,第一步反应在高温下进行,第二步反应在_________进行;从H2浓度的角度考虑,应采取的措施是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___。
(2)25℃、101kPa若适量的N2和O2完全反应,每生成23gNO2需要吸收16.95kJ热量___。
(3)25℃、101kPa已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为___。
(4)甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
已知反应①中相关的化学键键能数据如下:
化学键 | H—H | C—O | C | H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=___kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3=___kJ·mol-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com