
| A. | 再通入少量氯气,$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 | |
| B. | 加入少量的碳酸钠粉末,pH增大,溶液漂白性增强 | |
| C. | 加入少量固体NaOH,一定有c(Na+)═c( Cl-)+c(ClO- ) | |
| D. | 加入少量水,水的电离平衡向逆反应方向移动 |
分析 A.氯气与水的反应,加入氯气,溶液为饱和溶液;
B.碳酸钠与盐酸反应消耗氢离子结合化学平衡移动原理解答;
C.根据电荷守恒可知:c(Na+)+c(H+)=c(Cl-))+c(ClO-)+c(OH-),加入少量固体NaOH,溶液呈酸性,只有溶液为中性时c(Na+)=c(Cl-)+c(ClO-);
D.加入水,溶液酸性减弱,水的电离平衡向右移动;
解答 解:A.氯气溶于水达到平衡后,再通入少量氯气,此时已经为饱和溶液,浓度比值$\frac{c(H{\;}^{+})}{c(ClO{\;}^{-})}$不变,故A错误;
B.加入少量的碳酸钠粉末,使Cl2+H2O HCl+HClO向正向移动,氢离子浓度减小,次氯酸浓度增加,pH增大,溶液漂白性增强,故B正确;
HCl+HClO向正向移动,氢离子浓度减小,次氯酸浓度增加,pH增大,溶液漂白性增强,故B正确;
C.加入少量固体过氧化钠,反应后溶液中阴阳离子所带正负电荷总数相等,故存在c(H+)+c(Na+)=c(OH-)+c(Cl-)+c(ClO-),加入少量固体NaOH,溶液呈酸性,则有:c(H+)>c(OH-),所以c(Na+)<c(Cl-)+c(ClO-),故C错误;
D.加入少量水,溶于酸性减弱,促进水的电离,水的电离平衡向正反应方向移动,故D错误;
故选:B.
点评 本题考查了氯气、氯水的性质,侧重考查化学平衡、电离平衡的相关知识,题目难度中等.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:填空题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
| 平 衡 时 数 据 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | a kJ | b kJ | c kJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①用铜和浓硝酸制取少量NO2 | B. | ②比较S、C、Si的非金属性 | ||
| C. | ③验证HCl溶解性 | D. | ④用于吸收NH3尾气,并防止倒吸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3具有还原性 | B. | H-是很强的还原剂 | ||
| C. | H2是氧化产物,NH2$_2^-$是还原产物 | D. | 该反应属于置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL 18mol/L浓硫酸与足量铜加热充分反应,其中有0.09NA个H2SO4体现了氧化性 | |
| B. | 33.6LCl2一定能与56g铁在加热条件下发生反应 | |
| C. | 12.0g熔融的NaHSO4中含有的阳离子数为0.2NA | |
| D. | 在反应14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4中,5molFeS2发生反应,有21NA个电子发生转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用25mL的烧杯量取14.80mL NaOH溶液 | |
| B. | 用100mL的量筒量取5.2mL的盐酸 | |
| C. | 用托盘天平称取25.20g NaCl | |
| D. | 用100mL容量瓶配制80mL 0.1mol/L的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的密度不变 | B. | 混合气体的压强不变 | ||
| C. | 混合气体的平均相对分子质量不变 | D. | 的转化率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
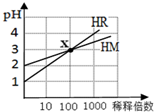
| A. | HR可能是弱酸 | B. | x点时c(R-)=c(M-) | ||
| C. | HM是一种强酸 | D. | 稀释前,c(HR)=10c(HM) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com