
CO(g)+H2O(g) H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下,说法正确的是 ( )
H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下,说法正确的是 ( )
| A.加入催化剂,改变了反应的途径,反应的△H也随之改变 |
| B.改变压强,平衡不发生移动,反应放出的热量不变 |
| C.升高温度,反应速率加快,反应放出的热量不变 |
| D.若在原电池中进行,反应放出的热量不变 |
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:单选题
在温度相同,压强分别为p1、p2条件下,A(g)+2B(g) nC(g)的反应体系中,C的体积分数(C%)随时间(t)变化的曲线如图所示.下列结论正确的是
nC(g)的反应体系中,C的体积分数(C%)随时间(t)变化的曲线如图所示.下列结论正确的是
| A.p1 > p2 n < 3 | B.p1< p2 n > 3 |
| C.p1< p2n = 3 | D.p1 > p2n > 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在容积一定的密闭容器中,进行可逆反应N2(g)+3H2(g) 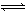 2NH3(g) ΔH<0,有图Ⅰ、Ⅱ所示的反应曲线(T表示温度,P表示压强,C%表示NH3的体积分数),下列说法中不正确的是
2NH3(g) ΔH<0,有图Ⅰ、Ⅱ所示的反应曲线(T表示温度,P表示压强,C%表示NH3的体积分数),下列说法中不正确的是
| A.T2<T1 |
| B.P2>P1 |
| C.若P3<P4,y轴表示N2的转化率 |
| D.若P3>P4,y轴表示NH3的体积分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某温度下,H2(g)+CO2(g)? ?H2O(g)+CO(g)的平衡常数K=9/4,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示,下列判断不正确的是
?H2O(g)+CO(g)的平衡常数K=9/4,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示,下列判断不正确的是
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol·L-1 | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol·L-1 | 0.010 | 0.010 | 0.020 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
重铬酸钾溶液中存在如下平衡:Cr2O72-(橙红色)+H2O  2H++2CrO42-(黄色),向K2Cr2O7溶液中加入下列哪种试剂,溶液颜色会从黄色逐渐变为橙红色
2H++2CrO42-(黄色),向K2Cr2O7溶液中加入下列哪种试剂,溶液颜色会从黄色逐渐变为橙红色
| A.NaHSO4 | B.NaHCO3 | C.Na2CO3 | D.CH3COONa |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在恒温恒容容器中,当下列哪些物理量不再发生变化时,表明A(g) + 2B(g) C(g) + D(g)已达平衡状态:
C(g) + D(g)已达平衡状态:
①混合ν气体的压强②混合气体的密度③B的物质的量浓度④混合气体的总物质的量⑤混合气体的平均相对分子质量⑥ν(C)与ν(D)的比值⑦混合气体的总质量⑧混合气体的总体积
A.①③④⑤ B.①②③④⑤⑦
C.①③④⑤⑧ D.①②③④⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
向甲、乙两个容积均为1L的恒容容器中,分别充入2molA、2molB和1molA、1molB。相同温度下,发生反应:A(g)+B(g) xC(g) △H<0测得两容器中c(A)随时间t的变化如图所示。
xC(g) △H<0测得两容器中c(A)随时间t的变化如图所示。
下列说法正确的是( )
A.甲、乙两容器中反应达平衡时,平衡常数K(甲)<K(乙)
B.将乙容器升温可使甲、乙容器内各物质的体积分数相同
C.若向甲容器中再充入2molA、2molB,则平衡时甲容器中0.78 mol/L<c(A)<1.56 mol/ L
D.x不可能等于2
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
金属锡的冶炼常用焦炭作还原剂:SnO2(s)+2C(s)==Sn(s)+2CO(g)↑,反应过程中能量的变化如图所示。下列有关该反应的ΔH、ΔS的说法中正确的是
| A.ΔH<0 ΔS<0 | B.ΔH>0 ΔS<0 |
| C.ΔH<0 ΔS>0 | D.ΔH>0 ΔS>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某兴趣小组为探究外界条件对可逆反应A(g)+B(g) C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为Ⅰ。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为Ⅰ。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
针对上述系列实验,下列结论中错误的是( )
| | A | B | C |
| Ⅰ | 0.050mol·L-1 | 0.050mol·L-1 | 0.050mol·L-1 |
| Ⅱ | 0.070mol·L-1 | 0.070mol·L-1 | 0.098mol·L-1 |
| Ⅲ | 0.060mol·L-1 | 0.060mol·L-1 | 0.040mol·L-1 |
| Ⅳ | 0.080mol·L-1 | 0.080mol·L-1 | 0.12mol·L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com