
| 温度℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
| A. | 上述反应是熵增反应 | |
| B. | 在80℃时,测得某时刻Ni(CO)4、CO浓度均为0.5 mol•L-1,则此时反应逆向进行 | |
| C. | 25℃时,反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数是0.5 | |
| D. | 恒温恒容,向已达平衡的容器中再充入少量Ni(CO)4(g),达到新平衡时,CO的体积百分含量将减小 |
分析 A.正反应为气体物质的量减小的反应,混乱度减小;
B.计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行;
C.相同温度下,反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数与Ni(s)+4CO(g)?Ni(CO)4(g)的平衡常数互为倒数;
D.恒温恒容,向已达平衡的容器中再充入少量Ni(CO)4(g),等效为增大压强,平衡正向移动.
解答 解:A.正反应为气体物质的量减小的反应,混乱度减小,则正反应是熵减反应,故A错误;
B.此时浓度商Qc=$\frac{0.5}{0.{5}^{4}}$=8>平衡常数K=2,故反应向逆反应进行,故B正确;
C.25℃时,反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数是$\frac{1}{5×1{0}^{4}}$=2×10-5,故C错误;
D.恒温恒容,向已达平衡的容器中再充入少量Ni(CO)4(g),等效为增大压强,平衡正向移动,达到新平衡时,CO的体积百分含量将减小,故D正确,
故选:BD.
点评 本题考查化学平衡影响因素、化学平衡常数计算及应用等,难度中等,注意掌握化学平衡常数的应用.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaO | B. | ZnO | C. | Na2CO3 | D. | Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯聚合为聚乙烯高分子材料符合绿色化学原子经济性要求 | |
| B. | 银制品久置干燥空气中因电化学腐蚀而使表面变暗 | |
| C. | 重金属盐能使蛋白质变性,所以误食重金属盐会中毒 | |
| D. | 在合成洗涤剂中添加酶制剂可以提高洗涤效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

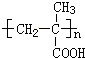 .
.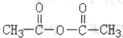 )作用制得.水杨酸的结构简式是
)作用制得.水杨酸的结构简式是 ,水杨酸可以看作羧酸类有机物,也可看作酚类有机物.
,水杨酸可以看作羧酸类有机物,也可看作酚类有机物.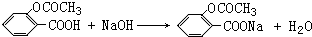 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钾投入水中 | B. | 镁条放入冷水中 | ||
| C. | KSCN溶液滴加到FeCl3溶液中 | D. | 氯水滴加到KI淀粉溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②⑥⑦ | C. | ①②④⑤ | D. | ④⑤⑥⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com