
| A. | 物质的量 | B. | 摩尔质量 | C. | 质量分数 | D. | 物质的量浓度 |
 寒假学与练系列答案
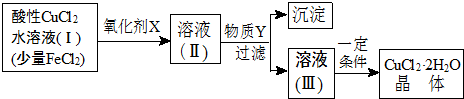
寒假学与练系列答案科目:高中化学 来源: 题型:推断题
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图:A处通入氯气,关闭B阀时,C处干燥红色布条无变化,打开B阀时,C处干燥的红色布条褪色.则下列说法正确的是( )
如图:A处通入氯气,关闭B阀时,C处干燥红色布条无变化,打开B阀时,C处干燥的红色布条褪色.则下列说法正确的是( )| A. | D中可以盛放浓硫酸 | B. | D中可以盛放饱和食盐水 | ||
| C. | D中可以盛放水 | D. | A处通入的是干燥的氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 依据分子组成中含有氢原子的数目,将酸分为一元酸、二元酸等 | |
| B. | 依据是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应 | |
| C. | 依据分散质粒子直径的大小,将分散系分为溶液、胶体、浊液 | |
| D. | 依据组成元素的种类,将纯净物分为单质和化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH═Na++O2-+H+ | B. | MgCl2═Mg2++Cl22- | ||
| C. | KClO3═K++Cl-+3O2- | D. | NH4NO3═NH4++NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com